- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
正确认识数据项 更好发挥UDID作用
 |
|
□ 易力 李军 郭媛媛 余新华
医疗器械唯一标识数据库(UDID)是储存产品标识(UDI-DI)与关联信息的数据库,公众、医疗器械生产经营企业、医疗机构等各方通过UDID快速获取医疗器械相关信息,是医疗器械唯一标识(UDI)制度落地的具体体现。UDID在UDI系统建设中具有重要作用。
我国UDID于2019年12月10日上线,于2020年3月31日开放数据库共享功能,以查询、下载、接口对接3种方式供各方查询使用。2020年6月,国家药监局发布YY/T 1752—2020《医疗器械唯一标识数据库基本数据集》和YY/T 1753—2020《医疗器械唯一标识数据库填报指南》2项行业标准,用于规范我国UDID建设和数据填报。2021年1月1日,首批9大类69个品种医疗器械产品实施UDI。截至2021年8月1日,我国UDID中已有约82万条主数据。
我国UDID基本情况
我国UDID具有静态、责任主体明确、数据项与国际接轨等特点。
我国UDID是一个静态数据库,只包含UDI-DI和相关信息,不包含医疗器械产品具体生产标识(UDI-PI)、生产计划、流向等动态信息。需要特别注意的是,我国UDID中虽有4个UDI-PI相关数据项,但仅为指示项,用于标明该医疗器械是否包含特定的UDI-PI,企业无须填写具体UDI-PI内容,可显著减少企业的数据维护量。
责任主体明确。国家药监局负责组织建立UDID,医疗器械注册人/备案人负责上传、维护和更新UDID中的相关数据,并对数据的真实性、准确性和完整性负责。
我国UDID数据项与国际接轨。我国UDID数据项积极借鉴《IMDRF UDI系统指南》中UDID核心数据元素和美国食品药品管理局全球医疗器械唯一标识数据库(GUDID)的数据元素,降低了境外注册人/备案人数据填写工作量。
数据项结构化。我国UDID数据项设计尽可能避免纯文本内容,例如将医疗器械使用和操作信息标准化为“储存或操作条件”“最低值”“最高值”“计量单位”“特殊储存或操作条件”5个结构化数据项,以避免发生单一纯文本项导致各方数据格式不统一现象。
融合当前医改趋势。我国UDID数据项设计考虑了当前医疗卫生体制改革“三医联动”要求和医院使用需求,“产品类别(设备或耗材)”和“医保编码”是医院使用医疗器械过程中经常用到的信息。
兼容多种填报方式。在填报方式上,我国UDID提供多种数据提交方式,包括网页填报、批量导入和申报接口3种方式,兼顾各类企业不同数据量的信息提交。
提供多种数据共享方式。我国UDID提供数据全量下载和增量下载方式,对于增量下载,数据库提供按月、周和日的增量数据,以满足不同应用场景的需求。此外,采用数据接口申报的企业,还可以通过接口方式实现数据共享和查询。
包含字段历史版本。部分医疗器械产品生命周期较长,UDID的历史版本下载功能有助于识别库存产品。
提供在线咨询功能。UDID对公众免费开放并设有“帮助台”模块,可解答企业填报和各方应用中遇到的问题。
兼容当前主流发码机构。我国UDI制度采取多发码机构并存的方式,数据库模块中包括发码机构及规则,有助于各方正确解析UDI相关信息。
基本数据集和重点关注数据项
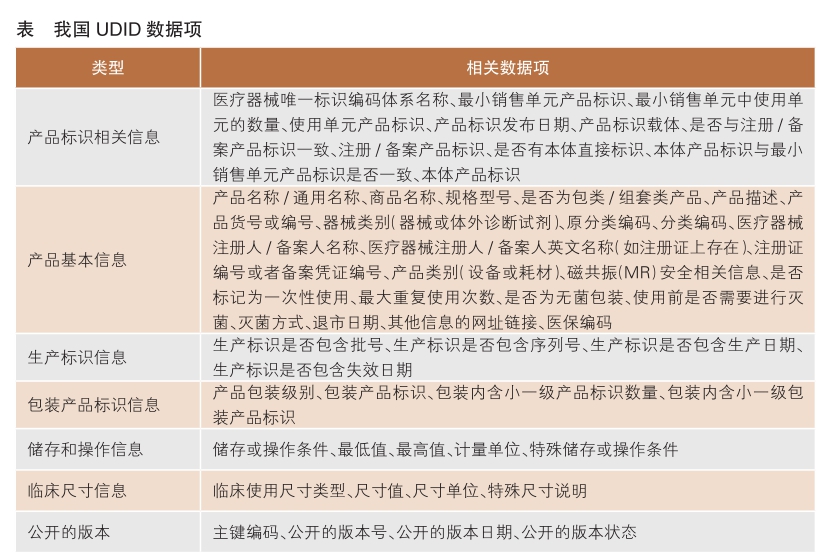
YY/T 1752—2020《医疗器械唯一标识数据库基本数据集》规定了UDID涉及的基本数据集类别、数据子集等内容,适用于UDID建设。根据该标准,UDID基本数据集主要包括UDID基本信息、医疗器械注册人/备案人联系信息和医疗器械唯一标识发码机构信息数据子集。其中,UDID基本信息数据子集是核心,包括医疗器械产品相关信息,对于各方快速准确识别医疗器械至关重要,是医疗器械注册人/备案人需要维护的主要部分,共42个数据项,是我国UDI的主体;其他2个数据子集包括医疗器械注册人/备案人联系信息和发码机构信息,对象并非医疗器械产品本身,填报对象仅需一次创建并及时更新即可。
我国UDID包括54个数据项,以UDID基本信息数据子集42个数据项为基础,另有12个数据项,其中8个为注册人/备案人填写,4个为系统自动生成的版本相关信息。截至2020年8月1日,54个数据项包括50个由医疗器械注册人/备案人填写的数据项目和4个系统自动生成的项目,在50个填写项中包括23个必选项、9个条件必选项和18个可选项。
UDID重点关注数据项为一致性数据项和条件触发数据项。
对于一致性数据项,以下数据项应与医疗器械注册证/备案凭证、标签或说明书保持一致:产品名称/通用名称、规格型号、产品描述、医疗器械注册人/备案人名称、注册证编号或备案凭证编号、是否标记为一次性使用、最大重复使用次数、磁共振安全相关信息。此外,产品包装、UDI-PI和灭菌等相关信息的填写,也应当遵循一致性原则。
相关数据项的填写会影响其他数据项的内容,正确理解对应的逻辑关系有助于提高数据填写的准确性。我国UDID中的条件触发数据项包括:是否有本体直接标识,选择“是”时触发“本体产品标识与最小销售单元产品标识是否一致”;本体产品标识与最小销售单元产品标识是否一致,选择“否”时触发“本体产品标识”;是否与注册/备案产品标识一致,选择“否”时应填写注册/备案时填写的最小销售单元产品标识;是否为包类/组套类产品,选择“是”时建议在产品表述中填写该产品的组成;器械类别(器械或体外诊断试剂)触发不同的分类目录;使用前是否需要进行灭菌,选择“是”时需要填写灭菌方式。
新UDI-DI触发及医保码关联数据项
《IMDRF UDI系统指南》提出,当发生可能导致医疗器械错误识别和/或可追溯性不明确的更改时,需要分配一个新的UDI-DI。《IMDRF UDI系统指南》规定了8个可能触发新UDIDI的数据元素,分别为品牌名称、医疗器械版本或型号、临床尺寸(包括体积、长度、规格、直径)、标记为一次性使用、无菌包装、使用前需要进行灭菌处理、包装中医疗器械的数目、关键警告或禁忌症。以上信息发生变化时,如不分配新的UDI-DI,可能导致产品无法被正确识别,轻则产生追溯和计费错误,重则造成使用错误,引起医疗事故。根据2019年8月国家药监局发布的《医疗器械唯一标识系统规则》,产品发生可能影响医疗器械识别、追溯的变更或者监管要求变化的,应当创建新的UDI-DI。当前,我国UDID中并未设置触发新UDI-DI的字段,参考IMDRF文件,我国UDID中类似字段包括最小销售单元中使用单元的数量、包装内含小一级产品标识数量、商品名称、规格型号、是否标记为一次性使用、是否为无菌包、使用前是否需要进行灭菌、磁共振(MR)安全相关信息。
2021年9月,国家药监局、国家卫生健康委、国家医保局联合发布《关于做好第二批实施医疗器械唯一标识工作的公告》。公告提出,在实施范围内的医疗器械产品从2022年6月1日起,如已在国家医保局医保医用耗材分类与代码数据库中维护信息,要在UDI D中补充完善医保医用耗材分类与代码字段,同时在医保医用耗材分类与代码数据库维护中完善UDI相关信息,并确认与UDID的一致性。UDID中设置了医保编码字段,为两码衔接应用提供了基础,该字段当前为选填,新要求的发布对该数据项的属性应当会作相应调整。
只有所有相关方都在工作流程系统中使用UDI,才能全面体现出UDI的益处。医疗器械注册人/备案人在填写数据项信息时,内容应当有依据,与医疗器械注册证/备案凭证、产品标签和说明书保持一致;医疗器械流通企业和使用单位应积极应用UDI开展相关管理,通过UDID提升医疗器械使用单位院内医用耗材资质管理水平,最大程度发挥UDID价值。
(摘编自《中国药事》2021年12月第35卷第12期)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






