- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
每周医药看点(12月3日—9日)
 |
|
12月3日—12月9日,医药行业的这些动态值得关注。
行业政策动态
1 国家药监局决定对丁桂儿脐贴说明书【不良反应】【禁忌】和【注意事项】项进行统一修订;对小柴胡制剂〔包括小柴胡颗粒、小柴胡胶囊、小柴胡汤丸、小柴胡汤丸(浓缩丸)、小柴胡片、小柴胡泡腾片〕说明书中的【不良反应】【禁忌】和【注意事项】项进行统一修订。
2 国家药监局网站发布第四十九批仿制药参比制剂目录,涉及维莫非尼片等药品。
3 国家医保局、人社部印发《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》。《目录》收载西药和中成药共2860种,其中西药1486种,中成药1374种,另外还有基金可以支付的中药饮片892种。
4 国家药监局药品审评中心(CDE)发布《基因治疗产品非临床研究与评价技术指导原则(试行)》《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》《基因治疗产品长期随访临床研究技术指导原则(试行)》,指导规范国内基因治疗产品非临床研究与评价和基因治疗类药物临床试验。三个指导原则均自发布之日起施行。
5 CDE发布《抗新冠病毒化学药物非临床药效学研究与评价技术指导原则(试行)》《抗新冠病毒肺炎炎症药物非临床药效学研究与评价技术指导原则(试行)》《新型冠状病毒中和抗体类药物非临床研究技术指导原则(试行)》,指导新冠病毒药物研发。三个指导原则均自发布之日起施行。
6 CDE发布《生物标志物在抗肿瘤药物临床研发中应用的技术指导原则》,为合理应用生物标志物指导抗肿瘤药物的临床研发提供可参考的技术规范。
7 CDE发布《体重控制药物临床试验技术指导原则》,鼓励和推动体重控制药物研发,规范临床研究设计和相关技术要求。
8 CDE就《静脉麻醉药的临床评价技术指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2022年1月6日;就《晚期前列腺癌临床试验终点技术指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2022年1月7日。
产品研发上市信息
1 国家药监局应急批准腾盛华创医药技术(北京)有限公司新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198)注册申请。这是我国首家获批的自主知识产权新冠病毒中和抗体联合治疗药物。
2 国家药监局发布2期药品批准证明文件待领信息,共包括36个受理号,涉及百奥泰生物制药股份有限公司等企业。
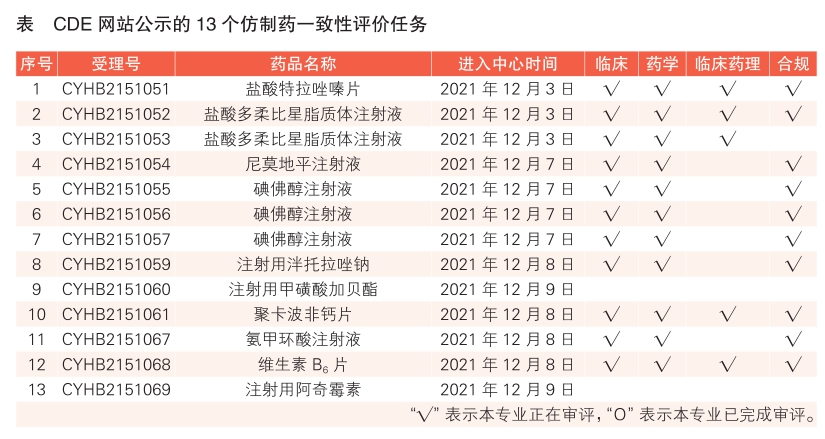
3 CDE网站公示13个仿制药一致性评价任务,涉及盐酸多柔比星脂质体注射液等药品(详见表)。
4 CDE承办受理43个新药上市申请,包括KF-0210片等药品。
医药企业观察
1 君实生物发布公告称,美国食品药品管理局(FDA)扩大其双抗体联合疗法——埃特司韦单抗(Etesevimab,JS016或LY-CoV016)和巴尼韦单抗(Bamlanivimab,LY-CoV555)的紧急使用授权(EUA),新增用于特定高风险儿科人群(从出生至12岁以下)的轻中度COVID-19治疗以及暴露后预防。
2 普利制药发布公告称,收到荷兰药物评价委员会(CBG)签发的地氯雷他定干混悬剂的上市许可。
3 甘李药业发布公告称,其全资子公司甘李药业美国公司GZR18进行I期临床试验的申请获得FDA批准。
4 贝达药业对外宣布,收到FDA签发的新药临床试验批准通知书,同意其第四代EGFR抑制剂BPI-361175片,用于治疗携带EGFR C797S突变及其他EGFR相关突变的非小细胞肺癌的药品临床试验申请。
药品集中采购
1 上海市医药集中招标采购事务管理所发布《关于开展2021年国家新增医保目录药品挂网工作的通知》,宣布开展2021年国家新增医保目录药品挂网工作,企业可以登录采购平台,对新增医保目录药品和新增医保谈判药品进行申报挂网。
2 山东省公共资源交易中心发布《关于公示国家组织集中采购第四批未中选药品价格调整情况的通知》,389个国采非中选品种正常挂网,437个国采非中选品种或将暂停交易。
3 宁夏公共资源交易网发布《关于开展医疗机构胰岛素专项集采待分配量选择工作的通知》,涉及品种包括餐时人胰岛素、基础人胰岛素、预混人胰岛素、餐时胰岛素类似物、基础胰岛素类似物、预混胰岛素类似物,共6个采购组。(刘思慧整理)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






