- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
【2025 年版《中国药典》标准解读】 2025年版《中国药典》制修订情况概述(下)
 |
|
□ 洪小栩 宋宗华等
2025年版《中国药典》主要变化
加快推进新技术、新方法、新工具标准转化应用
2025年版《中国药典》对标国际标准,紧跟国际制药发展前沿,不断扩大先进、成熟的检测技术在药品质量控制中的应用,进一步提高检测方法的灵敏度、专属性、适用性和可靠性,对加强药品质量控制、保障药品质量、提升药品监管能力发挥重要作用。
完善药品有效性控制要求
2025年版《中国药典》对标欧美药典,加强统一协调,《0931溶出度与释放度测定法》新增“往复架法”和“扩散池法”,为口服固体制剂质量一致性评价和相关特定剂型质量评价提供方法;新增《1402放射性药品生物分布测定法》,填补了国内空白;国际上,《中国药典》首次收载《9404基于基因修饰细胞系的生物检定法指导原则》,将有助于推动转基因技术产品研制和质控;新增《9405糖蛋白的糖基化分析指导原则》,对抗体药物的有效性评价提供了技术支撑;采用核磁共振氢谱法鉴别依诺肝素钠、达肝素钠和那屈肝素钙等低分子肝素类3种原料药,解决了原“低分子肝素”结构不清和分子量存在差异的问题,在标准要求上与欧美药典趋于一致;进一步扩大了高效液相色谱法、质谱法在化学药、生物制品有效成分检测中的应用,药品质量可控性进一步提升;新增《9031化学成像法指导原则》,与欧洲药典标准保持一致。
加强药品安全性控制方法及要求
2025年版《中国药典》在国际上率先新增收载《3309热原检查法(报告基因法)》,与传统家兔热原实验法相比,该法不使用动物,灵敏度高,稳定性好;加快完善分子生物学检测相关技术要求,新增《9110微生物全基因组测序技术指导原则》,为生产用菌毒种检定、外源因子污染检查、微生物精准鉴定、溯源分析和风险识别提供指导;新增《9016注射剂可见异物控制指导原则》,加强高风险制剂生产过程控制;基于细胞治疗产品效期短、批量小的特点,新增《9406细胞类制品微生物检查指导原则》,为特定生产工艺和特定产品的微生物污染控制提供控制策略,对创新药产品的研制提供了有力的技术支持,解决了细胞治疗产品放行检查的技术瓶颈。
强化药品质控检测技术储备
首次新增针对中药辐照检测方法,采用酶联免疫胶体金技术用于真菌毒素检测,建立植物生长调节剂检测法,为中药安全性控制提供有效的检测手段;新增《9024蛋白质组学分析方法以及微生物全基因组测序》通则,持续完善分子生物学检测技术要求在药典的收载;新增《9095多变量统计过程控制技术指导原则》《9096化学计量学指导原则》,指导生产过程分析技术方法开发和建立,更加适应现代生产工艺要求,为实现全过程质量控制提供规范的检测技术支撑。新增《0408原子荧光光谱法》,促进我国自主研制检测仪器的应用。
2025年版《中国药典》紧跟国际制药发展前沿,关注热点领域,加快推进医药创新形成的新技术、新方法、新工具标准转化,不断扩大成熟先进检测技术的应用,为药品质量控制提供规范性好、适用性强、应用稳定、可靠性高的检测方法,药品质量可控性得到显著提升。
持续加强药品安全性控制
完善中药安全性相关控制要求
认真贯彻落实《中共中央 国务院关于促进中医药传承创新发展的意见》任务部署,2025年版《中国药典》中,对于中药材及饮片禁用农药残留控制由原33种(55个单体)增加至47种(72个单体);根据GB 2763—2021《食品安全国家标准食品中农药最大残留限量》要求,2025年版《中国药典》新增枸杞子、人参、三七、百合、菊花、铁皮石斛、延胡索、金银花、贝母、白术10种中药材品种相应的农药残留限量标准;增加54个(包括药材和饮片检定通则52个品种、各论2个品种)中药材与饮片品种的重金属及有害元素限量要求;黄芪、槟榔药材增加了赭曲霉毒素A检查项;麸炒薏苡仁饮片项下增加黄曲霉毒素、玉米赤霉烯酮检查项;增订中药材植物生长调节剂测定方法,制定了麦冬中多效唑的限量要求;新增《9261辐照中药的光释光检查法指导原则》,以指导中药辐照灭菌检测;中药材及饮片安全性将得到进一步提升。
完善化学药品相关控制要求
重点加强化学药品杂质的控制要求,持续开展杂质定性定量研究,完善有关物质分离方法,更关注杂质的来源与分类,合理进行杂质的控制;增加对基因毒性杂质进行必要评估的提示;对2025年版《中国药典》收载的110多个品种标准的有关物质检查项目进行了增修订。
完善生物制品相关控制要求
完善了《生物制品生产用动物细胞基质制备及质量控制》《人用疫苗总论》《0233生物制品生产检定用菌毒种管理及质量控制》《0239生物制品分包装及贮运管理》等通则(总论);在各国药典中,率先收载《9403人用疫苗杂质控制指导原则》,指导疫苗研制和已上市产品的质量控制;规范抑菌剂的使用要求。2025年版《中国药典》三部收载的23价肺炎球菌多糖疫苗、森林脑炎灭活疫苗、双价肾综合征出血热灭活疫苗(Vero细胞)、双价肾综合征出血热灭活疫苗(地鼠肾细胞)、双价肾综合征出血热灭活疫苗(沙鼠肾细胞)、流感全病毒灭活疫苗、流感病毒裂解疫苗7个疫苗中不再添加抑菌剂,降低疫苗接种后产生不良反应的潜在风险,进一步提升疫苗的安全性。
加强高风险制剂的安全性相关控制要求
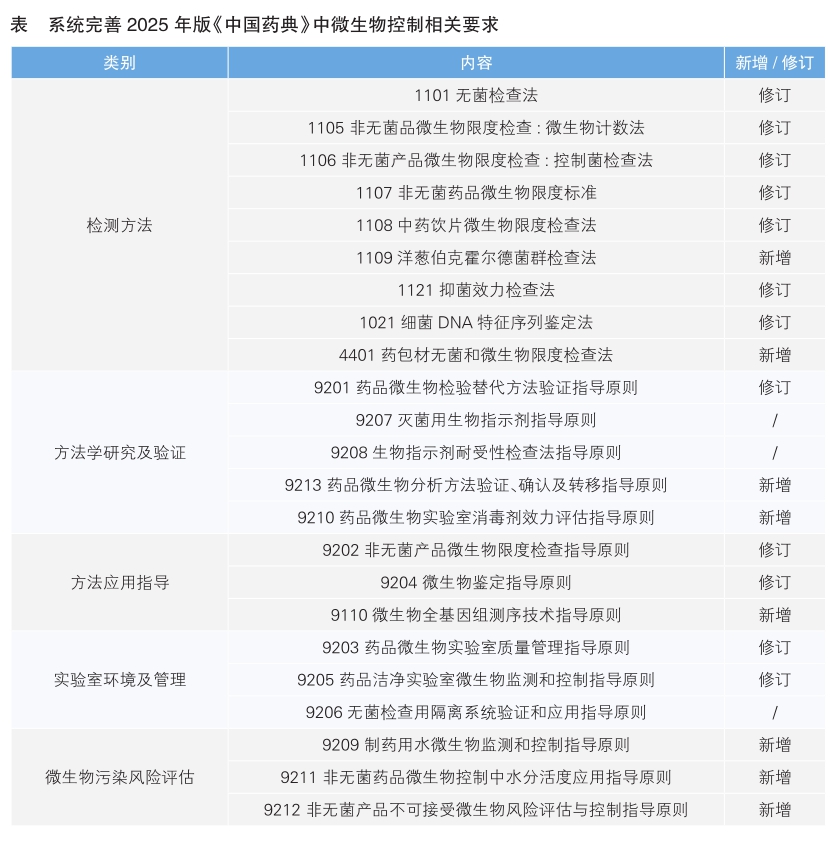
针对注射剂、吸入制剂以及眼用制剂等高风险制剂,建立了《9016注射剂可见异物控制指导原则》《9017吸入和鼻用制剂喷雾特性评价方法指导原则》《3903生物制品眼内注射剂不溶性微粒检查法》;完善微生物污染风险管控策略,新增《9211非无菌药品微生物控制中水分活度应用指导原则》《9212非无菌产品不可接受微生物风险控制指导原则》《1109洋葱伯克霍尔德菌群检查法》,加强对非无菌产品中致病菌污染的控制和监测,系统建立了涵盖检验方法、环境监控、方法验证、风险评估等方面的微生物控制技术标准(详见表)。
加强与国际标准的协调
ICH Q4B相关指导原则在《中国药典》的转化实施
对ICH相关指导原则,与欧、美、日等药典进行了对比研究,结合我国实际,通过采取直接协调和并行收载的方式,实现ICH Q4B全部16个指导原则在2025年版《中国药典》中的转化实施。通过“并行收载”方式协调的检测方法,《中国药典》原收载方法为第一法,ICH Q4B协调方法为第二法。新注册申报的品种在两种方法中可任选其一,并在检测项下标明采用的方法。已上市品种默认执行第一法,也可以通过上市后变更程序申请执行ICH Q4B协调方法。完善了《0861残留溶剂测定法》,新增《0862元素杂质》通则,修订《9101分析方法验证指导原则》《9098不确定度评定指导原则》等,实现了与ICH Q3C、Q3D、Q2(R2)、Q14等指导原则的协调统一,2025年版《中国药典》在药品关键质量控制要求方面与国际标准更加协调一致。
ICH Q系列其他指导原则的协调实施
通过增修订相关检测方法和指导原则,实现了2025年版《中国药典》与ICH Q2(R2)和Q14的协调;修订《0861残留溶剂测定法》、增加《0862元素杂质》通则,实现了2025年版《中国药典》与ICH Q3C和Q3D在指导原则上的转化协调。鉴于涉及已上市产品众多,针对Q3C和Q3D拟采取“逐步实施、稳步过渡”的策略,2025年版《中国药典》所涉及品种标准中仍保留检测项目要求,规定企业应基于风险评估,确定是否在原料药、辅料和制剂控制中实施残留溶剂、重金属、砷盐等的检查。2025年版《中国药典》“凡例”中也明确如涉及方法或限度的改变,应经批准后方可执行。
稳步推进体外实验替代体内实验
按照国际“3R”原则,推进体外生物学方法取代动物试验法。在《人用疫苗总论》《9301注射剂安全性检查法应用指导原则》等总论和指导原则中均规定了基于风险评估,实施异常毒性检查的要求,体现了近年来我国生物制品异常毒性检查的新理念和新举措,为企业简化放行检验提供了可能性,更好地与国际要求衔接。
加强与审评检查检验指导原则的衔接
加强药品标准与审评、检查、检验等技术要求的衔接,对于国家药监局药品审评中心已发布的指导原则,2025年版《中国药典》不再重复收载;修订《0239生物制品分包装与贮运管理》通则,以适用于细胞治疗类产品;根据国标GB 19422—2022中有关实验动物、微生物与寄生虫等级分类标准,对《0233生物制品生产检定用菌毒种管理及质量控制》通则进行了相应的修订,实现了与相关技术部门颁布标准的统一。
更加体现药品标准绿色环保理念
按照创新、协调、绿色、开放、共享的新发展理念,2025年版《中国药典》中原则上不再新增含濒危野生物种的中药品种,不再收载处方中含有穿山甲的13个品种;制定毒性管控中药标准物质(如乌头碱、马钱子碱和士的宁等)替代指导原则,并按照指导原则修订相关标准;药典二部修订了332个品种标准中的化学反应鉴别法等,删除或替换了其中使用的三氯甲烷、苯、汞试剂等40多种剧毒试药和管制试剂试药,最大限度地降低毒性强、污染大的检验检测试剂的使用,减少环境污染、降低人员伤害以及实验安全隐患。本版药典《0261制药用水》通则注射用水制法在原蒸馏法制备的基础上,增加了“采用一个等同于蒸馏的纯化工艺制备所得,其制备工艺应符合监管部门有关程序要求”的描述,对促进制药工业实践“绿色低碳、环境友好”迈出了一步。
结 语
2025年版《中国药典》编制工作始终秉承科学性、先进性、实用性和规范性的原则,紧跟国际药品标准发展前沿,结合我国医药产业发展实际,牢牢把握保障药品安全底线,促进医药产业发展高线,进一步强化以《中国药典》为国家药品标准核心的地位,大力开展药品标准提高行动计划,加快医药创新成果标准转化,不断加强与国际先进标准的协调,引入国际药品质量控制的管理理念,《中国药典》的特色更加鲜明,药品标准体系更加完善、标准门类更加齐全、药品质量更加可控、与国际标准更加趋同,药品标准整体水平迈上新的台阶。本版药典的颁布实施必将对保障药品质量、维护公众用药安全、强化药品监管技术支撑、提升中国制药国际竞争力、推动医药产业高质量发展发挥重要作用。
【摘编自:2025年版《中国药典》制修订情况概述[J].中国药品标准,2025,26(01):1—10】
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






