- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
【 2025年版《中国药典》标准解读】 2025年版《中国药典》制修订情况概述(上)
 |
|
 |
|
 |
|
 |
|
开栏的话
《中华人民共和国药典》(以下简称《中国药典》)是我国实施药品监管、保证药品安全有效的技术法规,是国家药品标准体系的核心。2025年版《中国药典》已于日前颁布,自今年10月1日起施行。
今日起,本版开设“2025年版《中国药典》标准解读”专栏,刊发相关专家的文章,深入介绍本版药典制修订情况、各部分修订内容等,以期为业界更好落实药典要求提供指导。敬请关注。
□ 洪小栩 宋宗华等
自第十二届药典委员会成立以来,全体药典委员认真落实习近平总书记“四个最严”要求,按照《“十四五”国家药品安全及促进高质量发展规划》任务部署以及《〈中国药典〉(2025年版)编制大纲》的工作规划,依托药品标准提高行动计划,在各级药品检验机构、科研院所、学会协会的支持和配合下,历经5年时间,国家药典委员会组织完成了2025年版《中国药典》编制工作。2024年11月27日,第十二届药典委员会执行委员会审议通过了2025年版《中国药典(草案)》。2025年版《中国药典》已在2025年3月,由国家药品监督管理局、国家卫生健康委员会联合颁布。《中国药典》是国家药品标准的重要组成部分,是国家药品标准体系的核心,是药品生产、检验、使用、监管的基本遵循和法定依据。自1953年我国颁布第一版《中国药典》以来,2025年版《中国药典》为第十二版药典。现就2025年版《中国药典》整体增修订情况介绍如下。
2025年版《中国药典》制修订整体情况
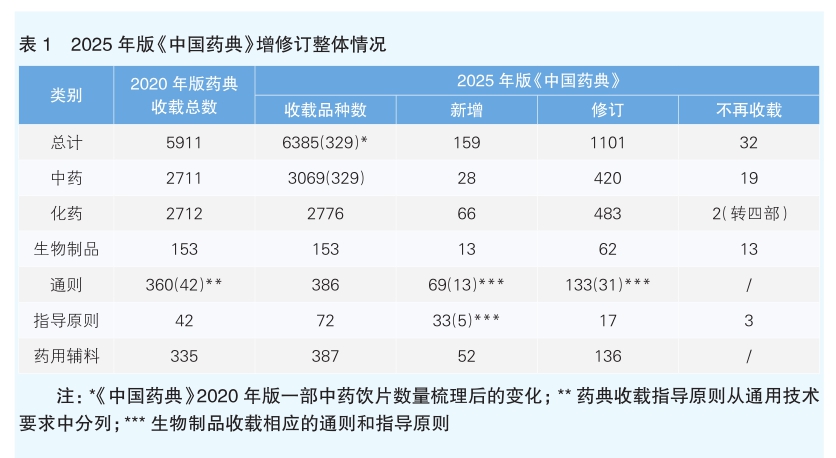
2025年版《中国药典》收载品种总计6385种,新增159种,修订1101种,不再收载32种。其中一部中药收载品种共计3069种,新增28种,修订420种,不再收载19种;二部化学药收载品种共计2776种,新增66种,修订483种,不再收载而转四部收载2个药用辅料品种;三部生物制品收载品种共计153种,新增13种,修订62种,不再收载13种;四部收载药用辅料共计387种,新增52种,修订136种。
本版药典收载通用技术要求共计410个,新增69个,修订133个。其中,三部生物制品新增通则(总论)13个,修订31个;四部新增通则56个,修订102个。
本版药典收载指导原则共计72个,新增33个,修订17个,不再收载3个(见表1)。其中,三部生物制品新增5个;四部新增28个,修订17个,不再收载3个。
2025年版《中国药典》主要变化
稳步推进药典品种收载
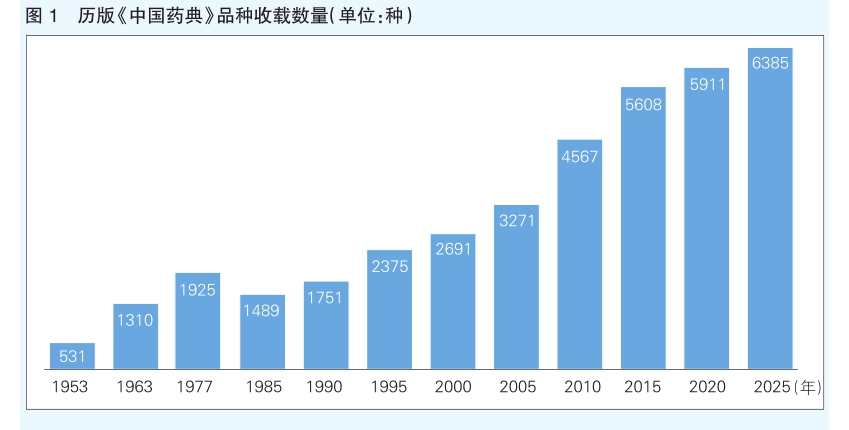
本版药典品种收载坚持以临床应用为导向,持续扩大国家基本药物目录和基本医疗保险用药目录品种的覆盖,进一步提升临床常用药品质量的可控性(见图1)。加快新批准上市药品标准收载,新增我国自主研发的抗癌药注射用洛铂和注射用三氧化二砷品种标准;在国际上率先收载我国自主研发且拥有自主知识产权的聚乙二醇化人生长激素注射液和金培生长激素注射液品种标准;首次收载我国拥有自主产权的双价人乳头瘤状病毒疫苗(大肠埃希菌)和13价肺炎球菌多糖结合疫苗(破伤风类毒素/白喉类毒素);首次收载利妥昔单抗、英夫利西单抗、曲妥珠单抗、贝伐珠单抗、阿达木单抗5个生物类似药标准,体现了我国医药创新研发新成果,进一步满足临床用药需求。同时,增加儿童用药标准收载,将仿制药质量和疗效一致性评价成果在药典标准中体现,临床用药的质量得到进一步保障。
持续健全国家药品标准体系
《中国药典》是国家药品标准体系的核心,药典收载的通用技术要求是构成《中国药典》标准体系的“四梁八柱”。本版药典制修订通用技术要求及指导原则共计252项,占收载总数的55%。进一步完善了以《中国药典》凡例为基本要求、通则(总论)为总体规定、指导原则为技术指导、正文品种为具体要求的《中国药典》标准体系,对贯彻药品全生命周期管理理念、全面加强药品质控要求,系统规范药品质量标准,整体提升我国药品质控水平具有重要意义。
规范药典凡例的要求
药典“凡例”是对药典标准的基本要求和共性规定。在做好与《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《药品注册管理办法》《药品标准管理办法》《中药标准管理专门规定》等法律法规衔接的同时,兼顾药典一部、二部、三部、四部特点,实现了药典各部“凡例”体例的统一规范和共性内容的协调一致。(1)按照新颁布的《药品标准管理办法》有关规定,为更好地体现《中国药典》执行的严肃性,重新定义了药典通用技术要求和指导原则,明确各自地位作用,将指导原则作为推荐技术要求。(2)在药典二部和四部“凡例”中,明确了ICH Q3C/3D指导原则转化实施的相关要求,进一步强化基于风险管控的理念,对元素杂质、残留溶剂、重金属及有害元素以及基因毒性杂质的控制要求和实施策略作出了规定。(3)药典一部“凡例”对中药材和饮片标准中【用法与用量】明确为“作为临床用药的指导,临床使用遵医嘱”。
完善药典标准体系
持续构建和完善多维度的《中国药典》标准体系,进一步加强横向涵盖药典凡例、制剂通则、总论、检验方法以及指导原则的制定和修订;纵向建立符合中药、化学药、生物制品、原料药、药用辅料、药包材特点的标准体系,贯穿药品全生命周期管理理念这一主线,填空白,补短板,持续完善药品研发、生产、流通和使用等全过程质量控制要求,将药品质控关口前移,加强药品过程和源头控制要求及相关检测方法建立,引入了风险识别和风险管控的理念,建立基于风险防控的质量控制策略,促进药品生产企业提高对产品的风险识别能力,更好地强化和落实企业药品质量安全主体责任,更全面有效地保障药品质量。
加强药品检验方法建立的规范性
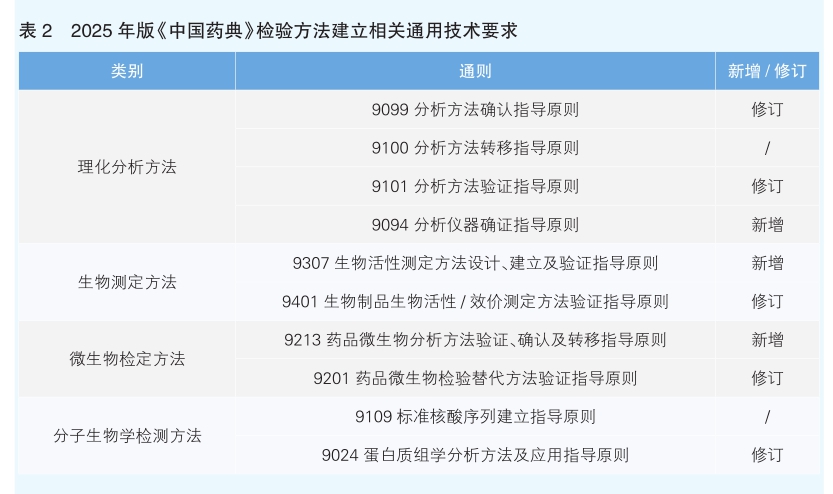
药品分析检测方法是药品质控的基础。规范各类分析检验方法的建立,是确保药品检验方法适用、可靠、稳定以及不同实验室检测结果一致性的重要前提。针对本版药典各类分析检测方法,进一步规范理化分析检测、微生物检查、生物活性检测和分子生物学检测方法建立和应用,制定了相应的技术规范(见表2),为保障《中国药典》科学性、规范性和可操作性夯实基础。
修订了《9101分析方法验证指导原则》,与国际主流药典保持协调一致;新增了《9307生物活性测定方法设计、建立及验证指导原则》,修订了《9401生物制品生物活性/效价测定方法验证指导原则》,为多组分复杂成分生物药的活性成分质控方法的建立提供指导。《中国药典》率先收载了《9213药品微生物分析方法验证、确认及转移指导原则》,为药品微生物污染控制方法的建立和控制策略提供指导。通过药典各类分析检测方法建立相关技术要求的制修订,在相关生物学、微生物检验方法建立和适用性研究方面更加有据可依,与国际通行的技术要求更加统一协调,药品检验方法建立和应用更加严谨规范,为加强药品质量可控性筑牢基础。
持续完善各类药品的标准体系
持续健全符合中药、化学药和生物药特点的质量标准体系。中药完善了《0212药材和饮片检定通则》《9302中药有害残留物限量制定指导原则》《9305中药中真菌毒素测定指导原则》,重点加强中药材及饮片安全性控制要求。为满足当前生物药快速发展的需要,制定和完善了单克隆抗体、抗体偶联药物、基因治疗产品相关通用技术要求,在国际上率先收载了《人用抗体偶联药物制品总论》《人用基因治疗制品总论》等,作为当前国际上药物研发的热点领域,相关总论的制定将有助于规范和指导药物研发,降低原创药物研发的风险,加速我国创新药研发上市,进一步体现《中国药典》的科学性、规范性、前瞻性和导向性。
完善制剂通则相关要求
药典《制剂通则》是对药典收载各类制品、各类剂型从制剂定义特征、生产制备、生产设施、制剂检验到贮藏运输等全过程的总体规定,是将药品全生命周期管理相关技术要求系统串联在一起的“主干线”,是药品质控的重要组成部分。此次对本版药典《制剂通则》项下39个剂型中的24个进行修订,重点完善了注射剂、吸入制剂、眼用制剂等高风险制剂生产和质控相关要求;完善了膜剂的有关规定,增加膜剂分类,分为口溶膜、口颊膜、舌下膜和口腔贴膜四个亚剂型;规范各类制剂抑菌剂的使用,药品安全性有效性将得到进一步提升。
持续健全药用辅料和药包材标准体系
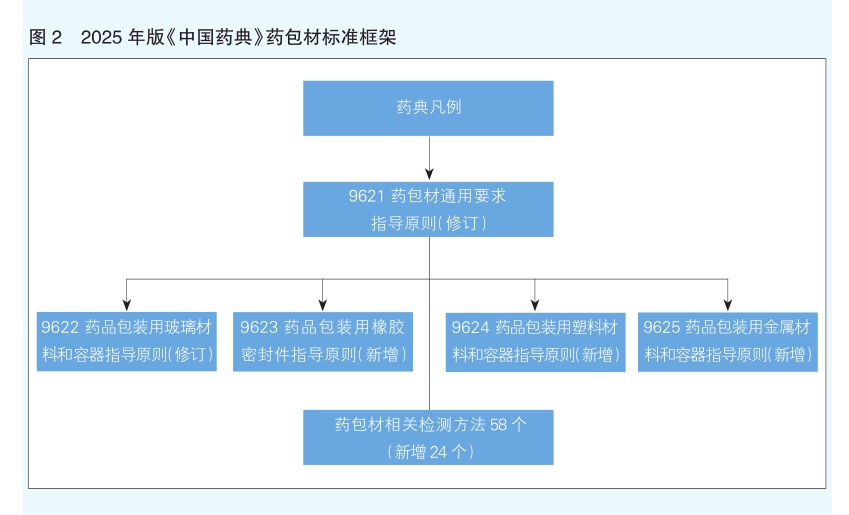
为保障原辅包关联审评审批制度的实施,做好技术支撑,持续构建基于药用辅料和药包材特点的标准体系的建立。在药用辅料控制方面,重点加强对药用辅料安全性和功能性评价相关要求,进一步推进药用辅料与国际标准的协调,新增药用辅料标准52个,本版药典收载药用辅料品种数总计达到387个,可进一步满足药物制剂常用辅料标准的需求。修订了《0251药用辅料》通则,强化对药用辅料生产制备、适用性研究以及标准执行的总体要求。修订了《9601药用辅料功能性评价指导原则》,完善了相关功能类别评价指标,新增了增溶剂、抑菌剂、渗透压调节剂、经皮渗透促进剂、冷冻剂五个功能类别,将原“包衣剂或增塑剂”拆分为“包衣剂”和“增塑剂”两个功能类别,完善功能性控制项目和方法收载,为制剂使用药用辅料适用性评价提供技术支持。在药包材方面,修订了《9621药包材通用要求指导原则》,在药典原收载《9622药用玻璃材料和容器指导原则》基础上,根据药包材材质的分类新增了橡胶类、塑料类、金属材料类包材指导原则(见图2),基本涵盖了药物制剂常用药包材的基本要求。在原收载16个药包材检测方法的基础上,增订了42个药包材理化、生物学、微生物以及生物安全性检测方法,以满足药包材鉴别、理化特性、功能性测试以及相关安全性测试的需求。
药品质控引入风险评估理念
本版药典在药品质控理念上与国际人用药品注册技术协调会(ICH)技术指南相一致,逐步形成了基于风险评估的质控模式,推动药品生产企业不单是机械地执行药品检验,而是基于产品给药途径、生产工艺、药物制备使用的设备设施、原材料、关键工艺环节等主动开展风险评估和分析研判,以保障最终制剂质量为目标,实施相应的风险管控策略,有针对性地设置药品检验项目,合理制定检测限度。如:《0212药材和饮片检定通则》中对52种药材和饮片中的重金属及有害元素规定了统一限度;药典三部“凡例”中对生物制品进行异常毒性检查明确了相关要求;药典二部“凡例”对于残留溶剂、元素杂质和遗传毒性杂质控制等控制要求,均体现了药品质控风险管控理念,基于风险评估,合理设置相应检测项目以及产品批放行实施与否。
【摘编自:2025年版《中国药典》制修订情况概述[J].中国药品标准,2025,26(01):1—10】
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有