- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
【生物类似药纵览】生物类似药的分离纯化
 |
|
分离纯化组成了生物类似药的下游处理阶段,这一过程和上游过程紧密联系。上游过程各个方面会影响到下游的分离纯化,因此在进行目标产品的分离纯化时需要统一考虑和整体设计,并充分考虑上游因素对下游的影响,如是否带有亲和标签、是否进行分泌表达等。
目前,应用最广泛的表达系统有三大类,分别是大肠杆菌表达系统、酵母菌表达系统和CHO细胞表达系统。不同的表达系统和培养方法会显著影响下游的处理过程,如目标产品表达是否形成包涵体、目标产品表达的定位(胞内、细胞内膜、周质空间和胞外)。选择将所表达的产品分泌到细胞外或周质空间可以避免破碎细胞的步骤,并且由于蛋白质种类少,目标产品容易纯化。在细胞质内表达的产品可能是可溶性表达,也可能形成包涵体。可溶性的产品往往需要复杂的纯化步骤,而包涵体易于分离、纯度较高,但回收具有生物活性的产品却相当困难,需要对聚集的产品进行变复性,通常活性产品的得率比较低。因此,针对不同的生物类似药需要设计不同的分离纯化工艺,以达到高质量、高收率的目的。
分离纯化常用单元操作原理
根据分子大小不同进行的分离纯化
生物类似药一般属于生物大分子物质,并且这类生物大分子的大小一般不尽相同。因此,可以利用一些较简单的方法使该类大分子物质和小分子物质分开,并使该类大分子混合物也得到分离。根据生物类似药物分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。
根据电荷不同进行的分离纯化
根据生物类似药的电荷(即酸碱性质)不同分离生物类似药物的方法主要为离子交换层析,包括阴离子层析和阳离子层析。
离子交换层析是以离子交换填料为固定相,填料基质由带有电荷的树脂或纤维素组成,依据流动相中的组分离子与填料基质上的平衡离子进行可逆交换时结合力大小的差别,从而进行分离的一种层析方法。当生物类似药处于不同的pH值条件时,其带电状况也不同,依据其自身电荷性质,通过结合/洗脱或者流穿模式达到分离纯化的目的。
根据配体特异性结合进行的分离纯化
亲和层析是利用生物类似药对其配体分子特有的识别能力建立起来的一种有效的纯化方法。它通常只需要一步处理即可将生物类似药从复杂的混合物中分离出来,并且纯度相当高。应用亲和层析须了解生物类似药的结构和生物学特性,以便设计出最好的分离条件。亲和层析技术被广泛应用于蛋白质尤其是单克隆抗体、疫苗、融合蛋白的分离纯化工艺中,极大地简化了生物类似药的下游工艺,同时产品质量也得到了较大提升。
疏水层析
疏水层析在单抗纯化过程中一般用于中间纯化或精纯步骤,根据工艺设计包括吸附和流穿两种模式。疏水层析是根据蛋白表面疏水性的不同,利用蛋白和疏水层析介质疏水表面可逆的相互作用来分离蛋白。
复合模式层析
复合模式层析在层析填料的配体和目标分子间提供了两种或多种相互作用方式,包括电荷作用、疏水作用等。这些不同的作用方式可以彼此独立存在,也可以共同存在,即可以在一个纯化步骤中进行基于电荷和疏水特性的纯化,其相互作用的强度取决于目标分子和工艺条件。
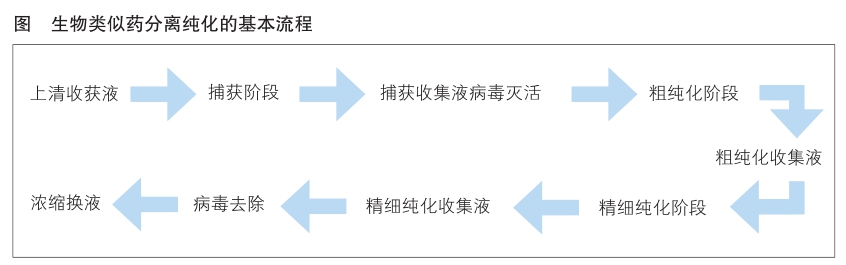
分离纯化基本流程
随着生物科技的不断进步,生物类似药的下游工艺手段日趋增多,针对不同种类的生物类似药所采用的分离纯化技术不尽相同,以生物类似药-单克隆抗体下游工艺为例,其在不锈钢系统中基本的分离纯化流程如图所示。
捕获阶段
对于单克隆抗体来说,第一步纯化分离工作是从收获的培养液中捕获目的蛋白。基于单克隆抗体的特点,最常用的手段即为亲和层析。
亲和层析过程所用的填料配基包括Protein A、Protein G和Protein L,根据单克隆抗体的特性选取配基合适填料进行装柱。首先,利用缓冲液将亲和层析柱进行平衡处理。随后,对收获培养上清进行过柱,捕获目的蛋白。捕获完成后,利用缓冲液冲洗掉未结合的杂蛋白、上游培养基成分等。最后,选取合适的洗脱缓冲液将结合在层析柱上的目的蛋白洗脱并收集到不锈钢收集罐中。
该阶段一般能够去除大量的杂质成分,大幅度提高目的蛋白的纯度,随后进入下一步骤的粗纯化阶段。
中间纯化阶段
在经过捕获阶段的纯化后,目的蛋白的纯度得到较大提升,但仍然含有较多的工艺杂质及产品杂质。
工艺杂质通常包含宿主蛋白(HCP)、宿主核酸(DNA)、内毒素以及上一步操作脱落的配基等,常采用离子交换层析或疏水层析进一步纯化以去除杂质。根据工艺杂质特点,常用的纯化操作单元主要是离子交换层析。宿主DNA、部分HCP等杂质在pH>4时通常带有负电荷,在一定的条件下能够结合到阴离子层析介质上,而蛋白以流穿的方式被收集,从而达到去除的目的,实现粗纯化。
精细纯化阶段
在经过前两步骤的纯化操作后,样品中的工艺杂质及宿主杂质基本能够满足相关的质量要求,该步骤精细纯化主要针对产品杂质进行设计。产品杂质主要包括产品高聚物、降解组分、电荷异构体、同源异构体和部分HCP等。因此,针对该类杂质主要采用疏水作用层析、离子交换层析等操作单元,来达到精细纯化的目的。
浓缩/换液阶段
该步骤主要是根据制剂处方,将经过分离纯化的样品通过浓缩/换液,从而把产品置换到制剂处方体系中,形成最终的产品。
病毒清除评价
目前,单克隆抗体大部分是经过CHO细胞株进行表达,而CHO细胞往往会存在内源性病毒。鉴于生物安全性的考虑,在整个下游工艺中,会设计病毒灭活与清除工艺。病毒灭活/清除的步骤主要包括灭活方法(低pH、S/D法等)和去除方法(20nm膜过滤法、层析等)。
分离纯化发展趋势
根据生物类似药的功能特点、来源、生产要求等,可以选择不同的方法模式来分离目标产品。但在实际应用中,目前对生物类似药的分离纯化还很难通过独立的方法实现,通常需要将几种方法综合起来才有望得到纯度较高的产品。同时,基因技术的发展带给人们更多关于控制生物类似药的结构、合成、折叠和分泌的信息,生物类似药的分离纯化发展的趋势之一是设计新的宿主优化生产和纯化。未来,将设计整合生物过程以降低成本,这些策略包括自动表达系统、新的介质和柱层析技术、在线监测系统等。
今后,生物类似药分离纯化的技术发展将围绕快速、高分辨率、易于操作、低成本和电脑控制的全自动化等技术展开。
另外,分离纯化技术的不断提高促进了生物类似药性质和功能的探索。对生物类似药性质的进一步了解在很大程度上提高了生物类似药的分离纯化技术,二者相互促进,有望共同推动生命科学领域的进步。
(摘编自《生物类似药从研发到使用》,中国医药科技出版社出版)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






