- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
8月份中美欧批准上市新药盘点
三款我国自主研发的新药在全球范围内首次获批上市
 |
|
 |
|
 |
|
□ 陈倩
今年8月份中美欧批准上市的新药中,美国批准上市的6款新药均为全球范围内首次获批上市。我国批准了7款新药上市,其中3款为全球范围内首次获批上市且是我国自主研发的新药。
中国批准七款新药上市
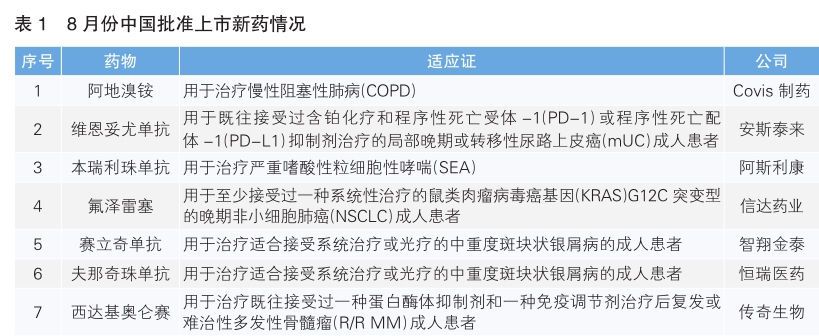
8月份,我国批准了7款新药上市。根据Pharmadigger数据库,氟泽雷塞、赛立奇单抗、夫那奇珠单抗为全球范围内首次获批的新药,且均为我国自主研发的新药。(详见表1)
阿地溴铵(商品名:Eklira)是Covis制药研发的一种长效毒蕈碱拮抗剂,通过抑制气道平滑肌中的毒蕈碱M3受体而产生支气管扩张作用。2014年,阿斯利康从Almirall公司获得了Eklira和Duaklir(阿地溴铵福莫特罗吸入粉雾剂)的全球权益。2022年1月,阿斯利康宣布将Eklira和Duaklir的全球权益转让给Covis 制药公司。
该药本次获批是基于一项名为AVANT的Ⅲ期临床研究。该研究共纳入了1060例中重度稳定期慢性阻塞性肺病患者,其中70%的参与者来自中国。研究结果显示达到了临床终点。该药此前已于2012年7月在美国获批上市。
维恩妥尤单抗(商品名:备思复)是安斯泰来和辉瑞旗下Seagen公司联合研发的Nectin-4(在膀胱癌中高度表达的一种蛋白)靶向抗体偶联药物(ADC),也是首个在我国获批的Nectin-4靶向ADC。该药本次获批是基于一项在中国开展的名为EV-203的单臂、开放标签、多中心的Ⅱ期桥接临床试验。试验结果显示,有37.5%的患者获得了经独立评审委员会(IRC)确认的客观缓解。该药此前已于2019年12月在美国获批上市。
本瑞利珠单抗(商品名:凡舒卓)是阿斯利康研发的靶向IL-5受体的单克隆抗体。本瑞利珠单抗是与嗜酸性粒细胞表面表达的IL-5Rα相结合的单克隆抗体。通过与IL-5Rα相结合,它能够募集天然杀伤细胞,通过诱发嗜酸性粒细胞的细胞凋亡过程来迅速清除这些细胞。在本瑞利珠单抗针对亚洲重度嗜酸粒细胞性哮喘(SEA)患者的Ⅲ期研究中,与安慰剂组相比,本瑞利珠单抗治疗48周可将患者年化急性哮喘加重率降低74%。该药此前已于2017年11月在美国获批上市。
氟泽雷塞(商品名:达伯特)是由信达生物和劲方生物研发、国家药监局批准上市的首个KRAS抑制剂,其通过阻断KRAS依赖的信号转导,抑制肿瘤细胞的增殖,并诱导细胞凋亡。该药本次获批是基于一项在中国开展的临床Ⅱ期单臂注册研究。截至2023年12月13日,共有116例非小细胞肺癌(NSCLC)受试者纳入分析。研究结果显示,有约一半的患者获得经独立影像学评审委员会确认的客观缓解,90%的患者获得疾病控制。
2021年9月,信达生物与劲方医药宣布达成全球独家授权协议,信达生物作为独家合作伙伴获得氟泽雷塞在中国的开发和商业化权利,并拥有其全球开发和商业化权益的选择权。
赛立奇单抗(商品名:金立希)是智翔金泰研发的一款重组全人源抗IL-17A单克隆抗体。银屑病是一种慢性自身免疫性疾病,是由机体免疫系统过度激活导致的皮肤细胞繁殖过快。斑块状银屑病是银屑病的一种常见表现形式,其特征为凸起的红色皮肤斑块被银白色鳞屑覆盖,并可能伴有瘙痒和疼痛。此前公布的赛立奇单抗Ⅲ期临床研究结果显示,赛立奇单抗组第12周达到银屑病面积和严重程度指数较基线至少改善75%(PASI 75)的受试者比例为90.7%,而安慰剂对照组为8.6%。
夫那奇珠单抗(商品名:安达静)是恒瑞医药开发的一种靶向人IL-17A的重组人源化单克隆抗体,可与IL-17A结合,阻断其与IL-17R的相互作用,导致下游炎性信号传导阻断。该药本次获批是基于一项名为SHR-1314-301的Ⅲ期临床试验。该试验结果显示,与安慰剂相比,夫那奇珠单抗注射液对中重度斑块状银屑病具有统计学显著性和临床意义的改善,达到了主要研究终点及关键次要研究终点。
西达基奥仑赛(商品名:卡卫荻)是传奇生物研发的一款靶向B细胞成熟抗原(BCMA)的嵌合抗原受体T细胞(CAR-T)疗法。该药本次获批是基于一项名为CARTIFAN-1的Ⅱ期临床研究。研究结果显示,在26.4个月中位随访中,患者总缓解率达到87.5%,其中79.2%的患者达到严格意义的完全缓解。该药此前已于2022年2月在美国获批上市。
美国批准六款新药上市
8月份,美国批准6款新药上市。根据Pharmadigger数据库,6款新药均为全球范围内首次获批的新药。(详见表2)
Afamitresgene autoleucel(商品名:Tecelra)是Adaptimune疗法公司研发的首款用于治疗实体瘤的工程化T细胞疗法,也是十多年来治疗滑膜肉瘤的首个有效疗法。Afami-cel是一种针对MAGE-A4癌症靶点的工程化T细胞受体(TCR)T细胞疗法,被设计作为一种用于晚期滑膜肉瘤的一次性疗法。目前,手术是滑膜肉瘤的首选治疗方法,有些患者会在手术前后接受放射治疗。此前,美国FDA已授予其治疗软组织肉瘤的孤儿药资格和治疗滑膜肉瘤的再生医学先进疗法认定。本次批准主要基于一项名为SPEARHEAD-1临床研究中队列1的积极数据。结果显示,44例患者的总缓解率为43%,完全缓解率为4.5%,中位缓解持续时间为6个月。
Vorasidenib citrate(商品名:Voranigo)是施维雅制药研发的一款具有脑渗透性与选择性的口服双重抑制剂,可抑制突变的IDH1/2蛋白。胶质瘤是由中枢神经系统内的胶质细胞或前体细胞引发的肿瘤。成人型弥漫性胶质瘤是成人最常见的原发性恶性脑肿瘤,其发病机制和预后与IDH突变密切相关。该药本次获批是基于一项名为INDIGO的Ⅲ期临床研究。研究结果显示,该药相比于安慰剂,可将患者疾病进展或死亡风险降低61%。
Palopegteriparatide(商品名:Yorvipath)是Ascendis制药研发的一种甲状旁腺激素(PTH)前药。它可每天将PTH恢复至生理水平24小时,以解决甲状旁腺功能减退的短期症状和长期并发症。甲状旁腺功能减退症是一种罕见的内分泌疾病,其特征是甲状旁腺激素水平不足,导致血液中低钙和磷酸盐水平升高。大多数患者是在甲状腺手术期间损伤或意外切除甲状旁腺后发生此疾病。钙补充剂和活性维生素D的常规治疗不能有效解决甲状旁腺功能减退的长期并发症或生活质量影响。该药本次获批是基于名为PaTHForward的Ⅱ期试验和PaTHway的Ⅲ期试验。试验结果显示,接受Palopegteriparatide治疗的患者中,78.7%的患者实现不依赖常规治疗保持血清钙水平在正常范围内,在安慰剂组此数值仅有4.8%。
Seladelpar(商品名:Livdelzi)是CymaBay公司研发的一款口服强效选择性过氧化物酶体增殖物活化受体δ(PPAR δ)激动剂。PPARδ表达在肝脏的多种细胞类型中,临床前数据表明,它对调控胆汁酸合成、炎症、纤维化过程的多种基因有调节作用。吉利德科学今年2月通过收购CymaBay公司而获得此药开发权益。该药本次获批基于名为RESPONSE的Ⅲ期研究。研究结果显示,62%的接受每日一次口服Seladelpar的受试者在第12个月达到了综合生化应答的主要终点,而此数值在安慰剂组中只有20%。
Axatilimab(商品名:Niktimvo)是Incyte公司研发的一种靶向集落刺激因子-1受体(CSF-1R)的单克隆抗体。该受体是一种细胞表面蛋白,被认为在控制单核细胞和巨噬细胞的存活和功能方面发挥作用。慢性移植物抗宿主病(cGVHD)是源于供体的血细胞对接受移植患者组织产生的免疫反应,是一种可能危及生命的并发症,发生在同种异体造血干细胞移植后,且可能持续多年。估计约有40%接受移植的患者会发展为cGVHD。cGVHD通常涉及多个器官系统,其中皮肤和黏膜最为常见,其特征是纤维化组织的形成。该药本次获批基于一项名为AGAVE-201的临床研究。研究结果显示,在接受Axatilimab推荐剂量的79名患者中,有3/4的患者获得总体客观缓解。
Lazertinib(商品名:Lazcluze)是强生公司研发的一种口服第三代脑渗透性EGFR TKI,既靶向T790M突变又靶向激活EGFR突变,同时保留野生型EGFR。Amivantamab(商品名:Rybrevant)是一款人源化EGFR/MET双特异性抗体,已于2021年5月获得美国FDA获批上市,用于治疗经FDA批准的检测发现EGFR外显子20插入突变、接受铂类化疗过程中或化疗后病情进展的局部晚期或转移性NSCLC成年患者。Lazertinib与Amivantamab的联用是第一个也是唯一一个直接针对两种常见EGFR突变的多靶点、无化疗联合方案。本次获批是基于Ⅲ期MARIPOSA研究的积极结果。该研究头对头对比了Amivantamab+Lazertinib与奥希替尼一线治疗高风险EGFR突变局部晚期或转移性NSCLC患者的疗效和安全性。结果显示,Rybrevant联合Lazertinib相比对照组降低了30%的疾病进展或死亡风险。
欧盟批准四款新药上市
8月份,欧盟批准了4款新药上市。根据Pharmadigger数据库,Odronextamab为全球范围内首次获批的新药(详见表3)。
Erdafitinib(商品名:Balversa)是强生公司研发的一款每日一次口服的FGFR激酶抑制剂,也是欧盟批准用于治疗带有FGFR3变异mUC成人患者的首个泛FGFR激酶抑制剂。本次获批基于一项名为THOR的临床研究。结果显示,对比化疗对照组,在之前接受过PD-1或者PD-L1抑制剂治疗的患者中,Erdafitinib降低患者死亡风险达36%。该药此前已于2019年4月在美国获批上市。
Odronextamab(商品名:Ordspono)是再生元研发的一款CD3/CD20双特异性抗体,可同时结合癌细胞上的CD20和T细胞上的CD3,从而促进局部T细胞活化和癌细胞杀伤。此次获批主要是基于Ⅰ期ELM-1研究和Ⅱ期ELM-2研究的积极结果。ELM-2研究的结果显示,在90例可评估疗效的至少接受过二线治疗的漫大B细胞淋巴瘤患者中,随访17.1个月时的ORR和完全缓解率分别为53%和37%。
Sotatercept(商品名:Winrevair)是默沙东研发的ⅡA型激活素受体(ActRⅡA)融合蛋白,它将ActRⅡA经过改造的细胞外域与抗体的Fc端融合在一起,可以阻断激活素与细胞膜上的受体结合,降低激活素介导的信号传导,从而降低肺血管阻力。该药此前已于今年3月在美国获批上市。
ADAMTS13(商品名:Adzynma)是武田研发的一种人重组具有血小板反应蛋白基序13的解整合素和金属蛋白酶。先天性血栓性血小板减少性紫癜是血栓性血小板减少性紫癜的一种亚型,是由于ADAMTS13缺陷所致。该药此前已于2023年11月在美国获批上市。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






