- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
3月份中美欧批准上市新药盘点
共计8款新药在全球范围内首次获批
 |
|
□ 陈倩
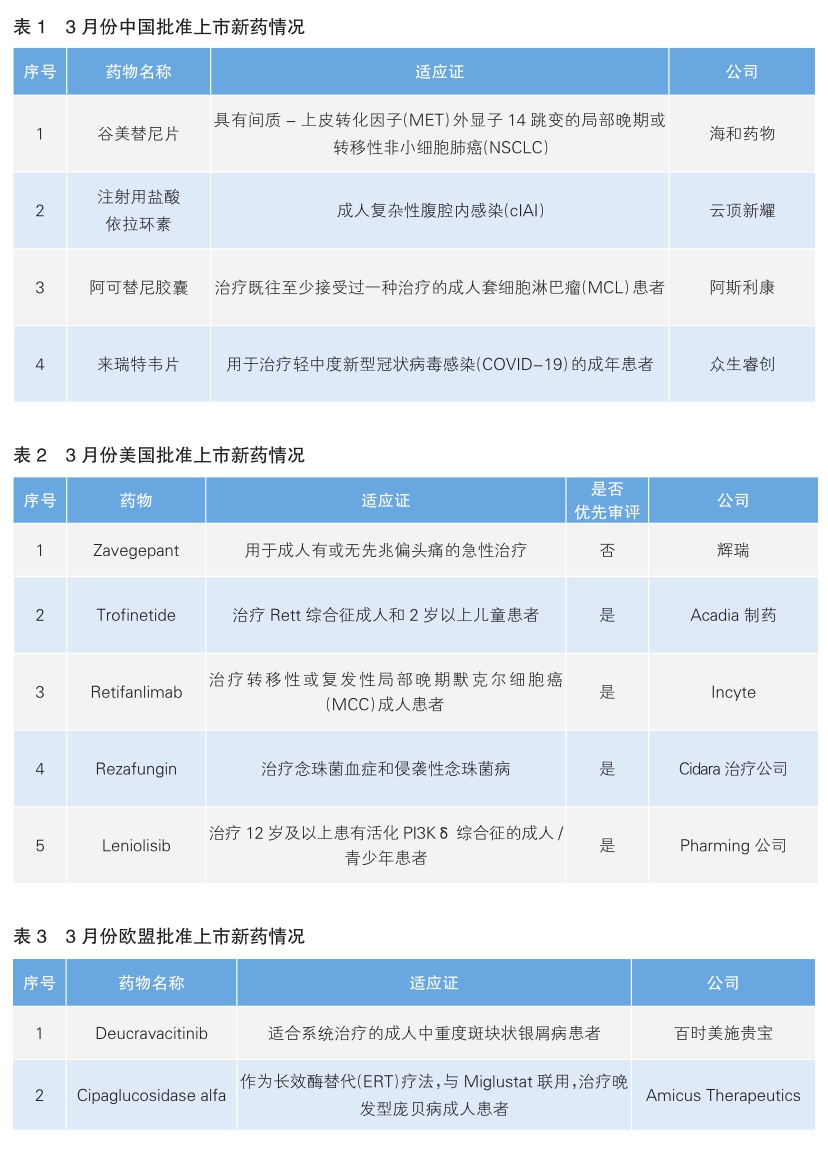
3月份中美欧批准上市的新药中,共有8款为在全球范围内首次获批上市。
我国批准4款新药上市
3月份,我国批准了4款新药上市。根据Pharmadigger数据库,这4款新药中,谷美替尼片和来瑞特韦片为我国自主研发并在全球范围内首先获批上市的创新药。
谷美替尼是上海海和药物研发的选择性c-Met激酶活性抑制剂。在我国非小细胞肺癌(NSCLC)患者中,Met外显子14跳变的发生率约1.3%,这类人群预后差,化疗药物二线治疗无进展生存时间(PFS)仅为2.9个月,总生存期(OS)为7.9~8.3个月。该药本次获批是基于名为GLORY的Ⅱ期临床试验,该试验纳入人群为存在MET外显子14跳变的局部晚期或转移性NSCLC患者,结果显示,BIRC(盲态独立评审委员会)评估有约2/3的患者获得客观缓解。
来瑞特韦是广东众生睿创研发的3CL蛋白酶抑制剂。本次获得附条件批准上市主要是基于来瑞特韦片治疗轻型和普通型COVID-19感染患者的随机、双盲、安慰剂对照Ⅲ期临床试验,结果显示已达到方案预设的主要疗效终点指标,来瑞特韦片不良事件发生率与安慰剂组相当。
依拉环素是Tetraphase制药公司研发的新型含氟四环素类广谱抗菌药物,云顶新耀[EVEREST MEDICINES (SINGAPORE)PTE.LTD.]于2018年2月与Tetraphase达成授权引进依拉环素的合作。与传统四环素不同,依拉环素进行了分子结构改进,使得抗菌谱更加广泛。它可以抑制除铜绿假单胞菌外的全部常见致病菌、非典型病原菌、多重耐药菌等。本次获批是基于两项阳性对照Ⅲ期临床试验,结果显示依拉环素治疗组的临床治愈率与对照组厄他培南或美罗培南均相似。依拉环素最早于2018年8月获美国食品药品管理局(FDA)批准上市。
阿可替尼是阿斯利康研发的选择性BTK抑制剂。此次获批是基于全球临床研究ACELY-004,以及在中国进行的针对既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)和其他B细胞恶性肿瘤患者的Ⅰ/Ⅱ期临床研究的结果。ACE-LY-004 研究结果显示,接受阿可替尼治疗的患者的中位PFS约为2年。该药已在美国被批准用于治疗慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤 (SLL),在欧盟和其他一些国家和地区获批用于治疗CLL。
美国批准5款新药上市
3月份,美国批准上市5款新药。根据Pharmadigger数据库,这5款新药均为全球首次批准上市。
Zavegepant(商品名:Zavzpret)是辉瑞公司研发的全球首个也是唯一一个降钙素基因相关肽(CGRP)受体拮抗剂鼻腔喷雾剂,是第三代高亲和力、高选择性的小分子CGRP受体拮抗剂,通过可逆性阻断CGRP受体,从而抑制CGRP神经肽的生物活性,缓解与预防偏头痛发作。此次获批上市是基于两项关键临床研究的积极数据,结果显示偏头痛成人患者接受Zavegepant 10mg治疗2小时后,分别有23.6%、22.5%的患者头痛缓解,而安慰剂组该数值约为15%,达到主要疗效终点。
Trofinetide(商品名:Daybue)由Acadia制药研发,是FDA批准的首款治疗Ret t综合征的药物。Rett综合征是一种复杂的、累及多个系统的神经发育障碍,由大脑神经元和突触功能所必需的X连锁MECP2基因突变引起。患者在经历一段正常发育期后,继而出现明显的发育倒退、语言和手部功能丧失、步态障碍等。Trofinetide是一种新型胰岛素样生长因子1(IGF-1)氨基末端三肽的类似物,通过减少神经炎症和支持突触功能来治疗Rett综合征的核心症状。此次获批是基于一项关键性Ⅲ期临床试验,该试验纳入了187名5~20岁女性Ret t综合征患者,结果显示,接受Trofinet ide治疗后,患者的Rett综合征行为问卷(RSBQ)总分从基线到12周的变化和临床总体印象-改善(CGI-I)量表得分相比于安慰剂组出现了明显改善。
Retifanlimab(商品名:Zynyz)是Incyte公司研发的PD-1单抗药物,是FDA批准的第五款PD-1单抗。此次获批基于一项开放标签、单臂的Ⅱ期临床试验POD1UM-201,结果显示在此前未接受过化疗的默克尔细胞癌(MCC)患者中,约有一半患者在接受Retifanlimab单药治疗后获得客观缓解。2019年7月,再鼎医药以1750万美元预付款加上6000万美元里程碑金额从Incyte引进该药物的大中华区权益。
Rezafungin(商品名:Rezzayo)是Cidara治疗公司研发的抗菌新药,是一种新型的、一周使用一次的棘球白素,其结构和特性经过改进,保留了棘球白素类药物的安全优势,同时增强了其药代动力学和药效学特性。本次获批是基于名为ReSTORE的Ⅲ期和名为STRIVE的Ⅱ期临床试验数据。结果显示Rezafungin每周给药一次,与目前每天给药一次的标准疗法卡泊芬净相比,主要终点第30天的全因死亡率具有非劣效性。
Leniolisib(商品名:Joenja)是Pharming公司研发的一款口服小分子选择性PI3Kδ抑制剂。APDS是由PIK3CD或PIK3R1突变引起的罕见原发性免疫缺陷,每百万人中大约有1至2人患上该疾病。APDS的疾病特征包括严重的复发性全肺感染、淋巴增生、自身免疫疾病和肠病。本次获批是基于一项Ⅱ/Ⅲ期临床试验的积极结果,受试者在使用Leniolisib后病灶处淋巴结比基线时显著变小。
欧盟批准2款新药上市
3月份,欧盟批准了2款新药上市,根据Pharmadigger数据库,这两款新药中,Cipaglucosidase alfa为全球首次获批的新药。
Cipaglucosidase alfa(商品名:Pombiliti)是Amicus Therapeutics公司研发的一种独特的人源重组酸性α-葡萄糖苷酶(rhGAA),其化学结构经过优化后可加强细胞对药物的吸收;Miglustat是一种口服酶稳定剂,旨在增强Cipaglucosidase alfa的肌肉靶向活性。这两种药物构成组合疗法AT-GAA,用于联合治疗成人迟发性庞贝病。庞贝病是一种由GAA缺乏所引起的遗传性溶酶体贮积症。本次批准是基于名为PROPEL的关键性Ⅲ期临床试验,结果显示,AT-GAA相比标准治疗方式具有临床意义上的改善效果。
Deucravacitinib(商品名:Sotyktu)是百时美施贵宝公司研发的口服、选择性酪氨酸激酶2(TYK2)变构抑制剂。它靶向的TYK2介导白介素-23(IL-23)、IL-12和Ⅰ型干扰素的信号传导。本次获批是基于名为POETYK PSO-1和POETYK PSO-2的Ⅲ期临床试验,结果显示,治疗16周和24周时,Deucravacitinib治疗组达到静态医生总体评估评分0或1分(sPGA 0/1)、银屑病面积与严重程度指数评分改善至少75% (PASI 75)的患者更多,应答可持续至第52周。该药此前已于2022年9月在美国获批用于治疗成年中重度斑块状银屑病患者。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






