- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
中国新药注册临床试验进展年度报告(2024年)(摘登)
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
(上接2版)
三、儿童用药及其临床试验
2024年药物临床试验中,含儿童受试者的临床试验为249项,在以受理号登记的新药临床试验中占比为9.8%(249/2539)。按药物类型分析,生物制品登记数量最多,为156项,其次为化学药品和中药。按适应证分析,生物制品主要为预防性疫苗和血液系统疾病药物,化学药品主要为皮肤及五官科药物、抗感染药物和抗肿瘤药物,中药主要为呼吸系统疾病药物。
针对儿童人群开展的临床试验共登记114项,在新药临床试验中占比为4.5%(114/2539)。按试验范围分析,国际多中心试验有15项。按药物类型分析,生物制品登记数量最多,为56项,其次为化学药品和中药,分别为40项和18项。按适应证分析,生物制品主要为预防性疫苗,占生物制品总体的32.1%,化学药品主要以呼吸系统疾病及抗过敏适应证为主,中药主要以呼吸系统疾病适应证为主。
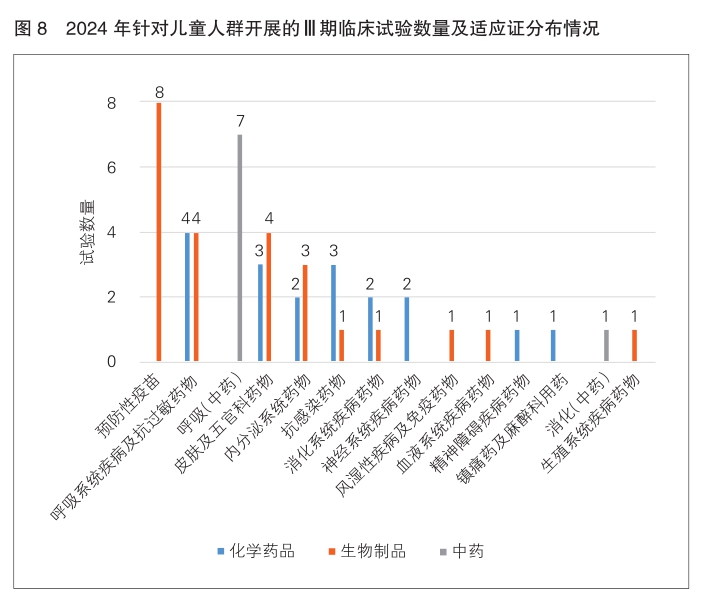
从试验分期分析,针对儿童人群开展的Ⅲ期临床试验占比最高,为43.9%(50/114)。在50项Ⅲ期临床试验中,位于前两位的适应证分别为预防性疫苗和呼吸系统疾病及抗过敏药物。(详见图8)
针对儿童人群开展的临床试验组长单位分布情况进行分析,114项儿童临床试验的组长单位分布于20个省、自治区、直辖市,其中北京市临床试验机构作为组长单位的试验最多,共39项,占总体的34.2%。
从参加单位分析,广东省参加机构参与儿童试验的次数最多,共134次,占总体的10.3%。
四、罕见疾病药物及其临床试验
以罕见疾病中文名称为关键字对罕见疾病药物临床试验进行分析。从临床试验数量上看,呈逐年递增趋势,2024年共登记121项。按药物类型分析,治疗罕见疾病的药物主要为化学药品和生物制品,分别登记了39项和82项。按适应证分析,主要以血液系统疾病、神经系统疾病和抗肿瘤药物为主,共计77项,占年度罕见疾病药物临床试验总量的63.6%,其中血液系统疾病药物临床试验数量最多,共34项,占年度罕见疾病临床试验总量的28.1%。
五、细胞和基因治疗品种及其临床试验
2024年细胞和基因治疗类药物新增首次登记临床试验115项(以CTR计),较2023年增加了42.0%(115vs.81)。上述115项试验共涉及100个品种(以药品名称计),其中细胞治疗类62个品种,基因治疗类38个品种,适应证以抗肿瘤为主(50项,43.5%)。
从临床试验数量分析,细胞治疗类62个品种共登记临床试验75项,占比为65.2%(75/115);基因治疗类38个品种共登记临床试验40项,占比为34.8%(40/115)。临床试验项目数量占比较高的依次为干细胞类29项(25.2%)、CAR-T类27项(23.5%)、溶瘤病毒类8项(7.0%)和肿瘤浸润淋巴细胞(TIL)类6项(5.2%)。
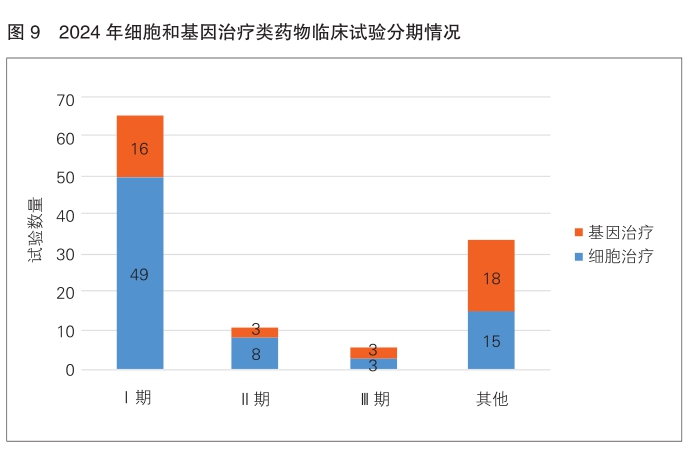
从试验分期分析,细胞和基因治疗类药物临床试验以Ⅰ期临床试验为主,共登记65项,占比为56.5%(65/115);Ⅱ期试验11项,占比为9.6%;Ⅲ期临床试验6项,占比仅为5.2%;其他试验33项,占比为28.7%。(详见图9)
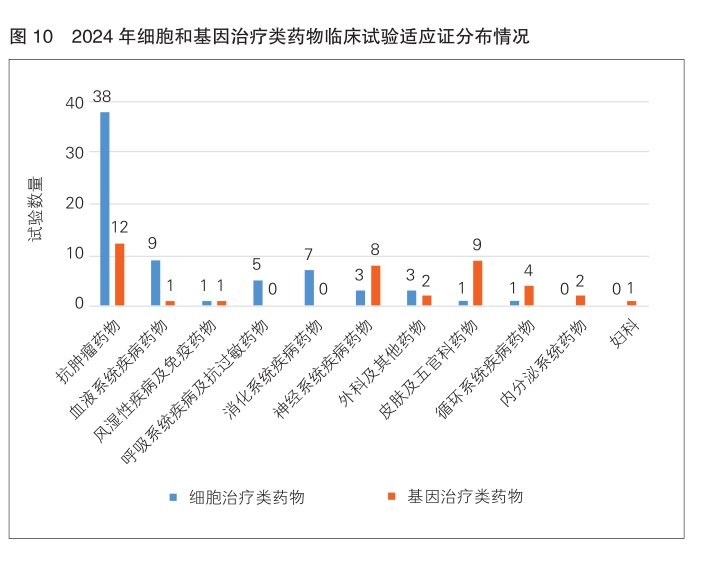
从适应证分类分析,细胞治疗类75项临床试验中抗肿瘤为38项,占比50.7%,其次为血液系统疾病9项(12.0%)。基因治疗类40项临床试验中抗肿瘤为12项,占比30.0%,其次为皮肤及五官科9项,占比22.5%,神经系统疾病8项,占比20.0%。(详见图10)
对2024年新增首次登记占比较高的29项干细胞类临床试验进一步分析:(1)从试验分期分析,Ⅰ期临床试验15项(51.7%)、Ⅱ期临床试验3项(10.3%)、Ⅲ期临床试验2项(6.9%)、其他类型试验9项(31.0%)。(2)从细胞来源分析,间充质干细胞21项(72.4%)、造血干细胞5项(17.2%)、多功能分化干细胞1项(3.4%)、其他来源干细胞2项(6.9%)。(3)从适应证分析,干细胞类临床试验均为非肿瘤适应证,占比较高的依次为血液系统疾病7项(24.1%)、消化系统疾病6项(20.7%)、呼吸系统疾病5项(17.2%)。
六、医学影像学和放射性药物及其临床试验
2024年以受理号登记的医学影像学和放射性药物临床试验共23项,涉及20个品种(按药物名称计),以国内临床试验为主。Ⅰ期临床试验最多,共11项。对比近年来数据,呈逐年增加趋势,2019年至2023年分别为0项、5项、8项、11项和14项。
七、老年人群药物临床试验
2024年药物临床试验中,含老年人受试者的临床试验为1831项,在以受理号登记的新药临床试验中占比为72.1%(1831/2539),仅在老年人群中开展的临床试验为3项。
第四章
临床试验实施情况
一、临床试验的国内外分布
从总体看,药物临床试验以国内临床试验为主。2024年国内药物临床试验占比为92.7%(4540/4900),国际多中心试验占比为6.9%(339/4900),对于不在中国招募受试者或仅在国外开展的单中心临床试验,按“其他”分类进行统计,其占比为0.4%(21项)。2024年以受理号登记的2539项新药临床试验中,新药国际多中心试验337项,占比为13.3%,国内试验2201项,占比为86.7%,其他1项。
二、临床试验组长单位
2024年以受理号登记的药物临床试验中,北京市临床试验机构作为组长单位参加临床试验的次数最多(如1个临床试验单位同时作为多项临床试验的组长单位,则按其参加临床试验的次数分别统计一次),共867次,超过总体的1/5(26.7%,867/3250)。
2024年临床试验组长单位分布占比前5位的分别是北京市、上海市、江苏省、湖南省和广东省,占比分别为26.7%、17.4%、9.2%、5.8%、3.8%。
三、临床试验参加单位
2024年登记的全部药物临床试验共涉及国内外临床试验单位5.7万余次(如1个临床试验单位同时作为多项临床试验的参加单位,则按其参加临床试验的次数分别统计一次),其中涉及中国(含港澳台)参加单位共计3.5万余次。与2023年相比,分别增加了19.8%和26.6%。
2024年临床试验参加单位超2000次的有6个地区,较去年增加3个地区,包括广东省、北京市、江苏省、河南省、浙江省和山东省。广东省为参加单位次数最多的地区,共2892次。
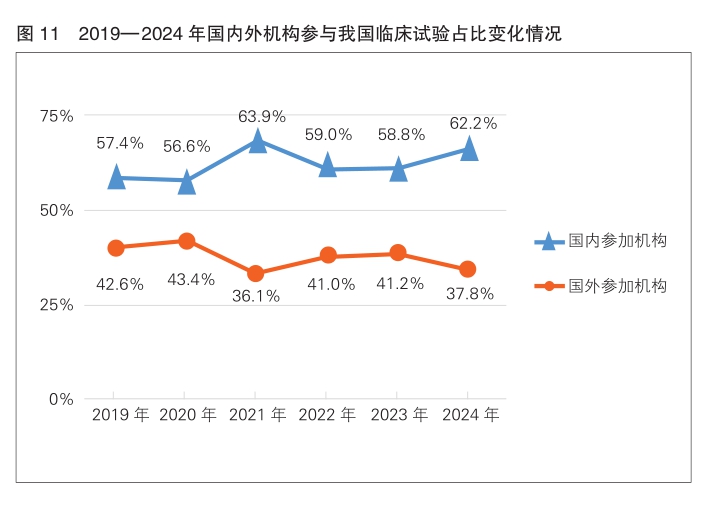
2024年,国内、国外机构参与我国临床试验占比分别为62.2%和37.8%。(详见图11)
第五章
临床试验实施效率分析
一、首次临床试验登记用时分析
根据临床试验获批日期(或BE备案日期)和申请人首次提交登记日期对试验登记用时进行分析。首次获批日期(或BE备案日期)在2024年内并完成首次提交的共计3367项,其中受理号登记1108项(32.9%),BE备案登记2259项(67.1%)。
受理号登记平均用时为67.4天(1~345天),相比2023年缩短了11.1天。申请人在2个月内完成登记并提交的占比接近60%,1个月以内完成登记并提交的占比为39.1%,相比2023年均进一步提高。
BE备案登记平均用时为12.1天(1~213天),相比2023年缩短了4.5天。约97.9%的申请人可在2个月内完成登记并提交,其中1个月以内完成登记并提交的占比为91.7%,相比2023年均进一步提高。
二、启动临床试验用时分析
2024年国内签署首例受试者知情同意书(ICF)的新药临床试验共1093项(同品种登记多项试验的,以首个登记试验计算),根据国内首例ICF日期和临床试验获批日期计算临床试验启动用时,平均值为11个月,较2023年缩短1个月。
总体上,超六成试验(65.5%,716/1093)在6个月内签署首例知情同意书,相比2023年(56.3%)进一步提高。从药物类型上看,中药、化学药品和生物制品在6个月内签署首例知情同意书的比例分别为27.5%、64.4%和70.2%,较2023年均有所提高。
如仅对2024年临床试验获批后当年签署首例知情同意书情况进行分析,2024年共计587项,启动用时范围为1天~9个月,6个月内签署首例知情同意书的比例为96.9%。与2023年相比,6个月内签署首例知情同意书的比例进一步提高(2023年为93.4%)。
三、临床试验完成情况分析
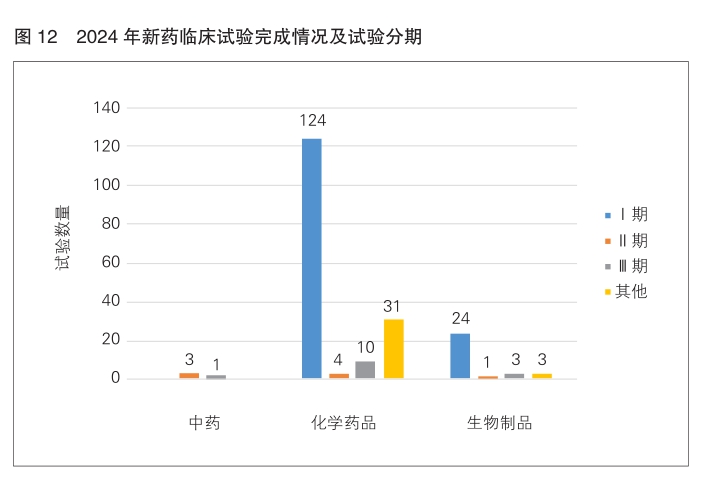
2024年以受理号登记的2539项新药临床试验中,当年完成(试验状态为“已完成”,且试验完成日期在2024年内)204项,均为国内试验,主要以Ⅰ期临床试验为主(148项,72.5%)。按药物类别分析,化学药品完成最多(169项,82.8%),含10项Ⅲ期临床试验;生物制品和中药分别完成31项和4项,其中Ⅲ期临床试验分别为3项和1项。(详见图12)
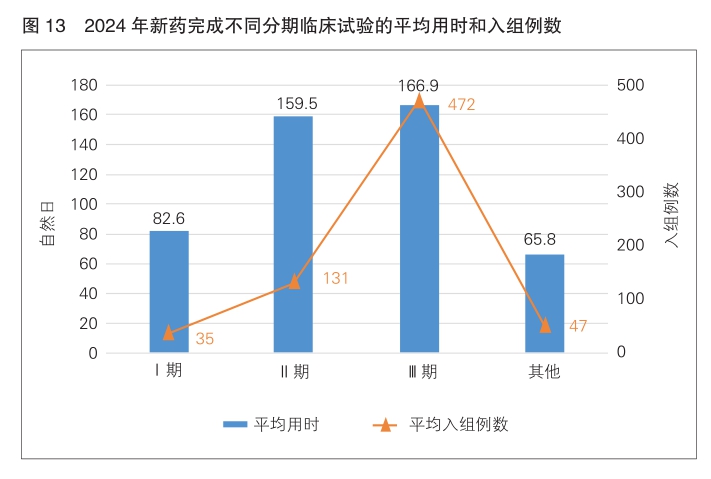
根据国内试验完成日期(2024年内)和国内首例ICF日期对完成临床试验的用时进行分析,试验完成用时范围为1~306天(自然日),平均为88.6天。按试验分期分析完成用时,“其他”临床试验平均用时最短,为65.8天(平均入组47例);其次为Ⅰ期临床试验,平均用时为82.6天(平均入组35例);Ⅲ期临床试验用时最长,为166.9天(平均入组472例)。(详见图13)
四、登记信息审核情况分析
以进入中心时间统计,2024年共计接收4947项首次登记任务(含受理号登记和备案号登记)。按审核完成时间统计,2024年共计审核完成4930项首次登记任务,总体审结率为99.6%。
需要指出的是,申请人应及时查阅登记信息审核状态和审核意见,尽早按审核意见进行修改,避免影响首次公示日期,进而影响试验进度。
第六章
临床试验质量控制情况
一、数据监查委员会(DMC)建立情况分析
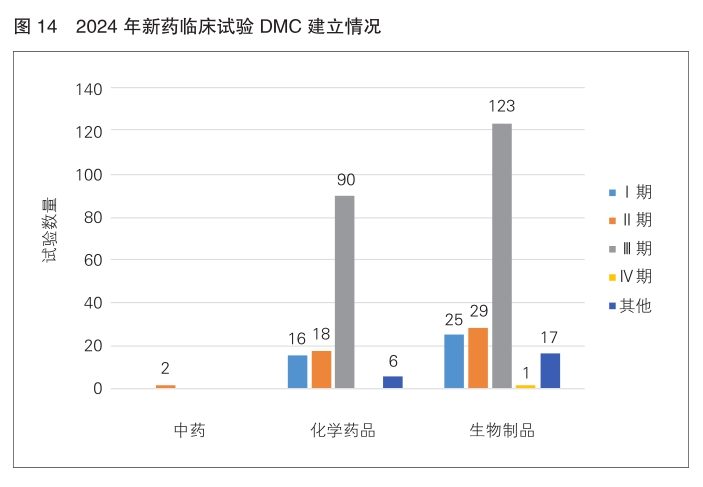
2024年以受理号登记的2539项新药临床试验中,建立数据监查委员会(DMC)的临床试验共计有327项(12.9%)。从药物分类分析,生物制品建立DMC的比例最高,为59.6%(195/327);其次为化学药品,为39.8%(130/327)。从试验分期分析,Ⅲ期临床试验建立DMC的比例最高,为65.1%,Ⅰ期和Ⅱ期临床试验建立DMC的比例分别为12.5%和15.0%。与2023年相比,Ⅲ期临床试验建立DMC的比例增加近10%。(详见图14)
二、暂停、终止临床试验情况分析
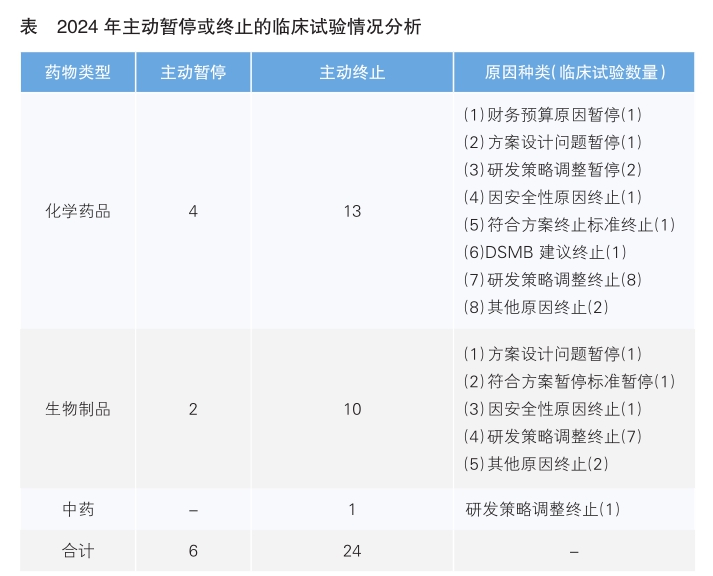
2024年无责令暂停或责令终止试验情形。主动暂停6项(化学药品4项、生物制品2项),主动终止24项(中药1项、化学药品13项、生物制品10项),暂停和终止原因如下表:
(来源:国家药监局药品审评中心网站)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






