- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
以临床价值为导向 确保产品安全有效
——简析金属骨针类产品设计开发及技术审评关注点
 |
|
□ 李晓云
金属骨针作为骨科手术中的关键植入器械之一,广泛应用于骨折固定、畸形矫正及关节融合等领域。近年来,随着材料科学和制造技术的进步,金属骨针的设计逐渐从单一功能向精准化、个性化方向发展。
骨科医疗器械市场虽然技术迭代迅速,但临床效果并未同步提升。这与传统医疗器械设计过度关注技术参数而忽视临床实际不无关系。这种脱节现象凸显了以临床价值为导向设计产品的必要性。
临床价值导向要求设计直接回应未被满足的临床需求,如缩短手术时间、降低感染风险等。以临床价值为导向的设计不仅能提高治疗效果,还能降低治疗成本。研究表明,通过优化医疗器械产品设计减少术后并发症,可使单例患者的综合治疗成本降低30%。
设计开发关注点
金属骨针类产品作为骨科比较成熟的医疗器械产品之一,生产研发历史较长。此类医疗器械的设计开发需紧密围绕骨针类产品在临床的预期适用范围来进行,如四肢骨折复位时部分植入人体做牵引、配合外固定支架进行四肢骨折固定或单独植入等。因此,金属骨针的设计开发需要重点关注以下几点。
材料选择与性能优化
材料类型:材料类型的选择需要权衡力学性能与生物学响应。如316L不锈钢成本相对低、钛合金生物相容性较优、钴铬合金耐磨性较强等。
表面改性:如羟基磷灰石(HA)涂层可提升骨整合,但需要控制结晶度在60%~70%,以避免剥落风险。
结构设计与制造工艺
几何参数:如螺纹深度、螺距需要匹配骨密度分布。有限元分析显示,锥形设计可减少40%应力集中。
制造技术:如增材制造可以支持复杂结构,但需要验证内部缺陷率(应<0.1%)。
生物相容性与力学验证
该类产品应参照GB/T 16886.1进行生物学评价,必要时开展相应生物学试验,如细胞毒性、致敏性及植入后局部反应。
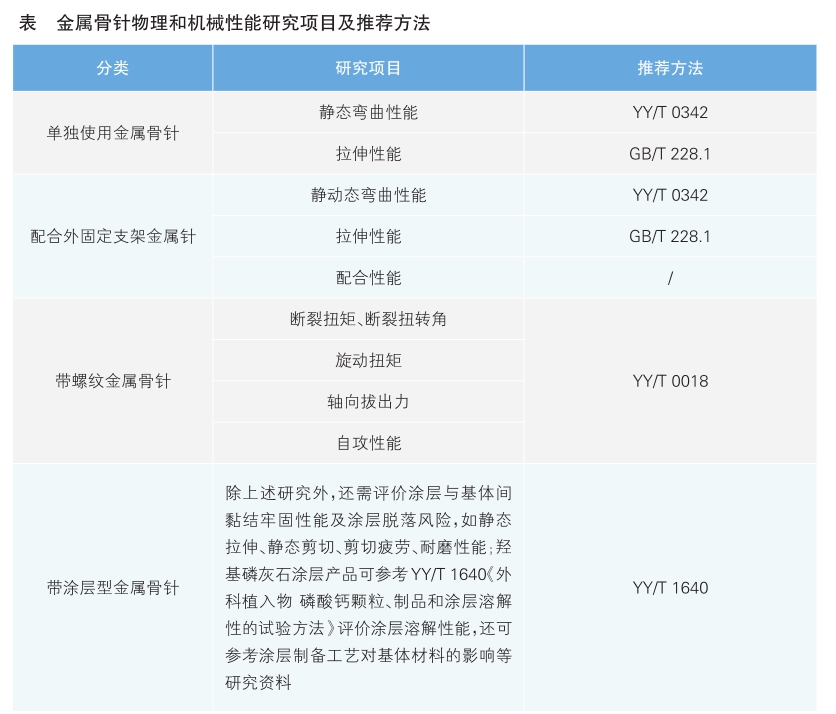
力学测试方面,可参照相应标准要求对骨针开展动静态力学性能测试,以评估其机械性能(详见表)。
技术审评关注点
根据现行法规、标准体系及当前认知水平,金属骨针类产品在技术审评时需关注以下内容。
非临床研究部分
这部分研究应包括产品技术要求与性能指标(如抗拉强度、断裂伸长率、不锈钢产品的耐腐蚀性能、表面缺陷、表面粗糙度),外观,关键尺寸及公差,无菌,环氧乙烷残留量。对于带涂层骨针,还需要明确涂层表面粗糙度、涂层与基体黏接强度。
研究资料包括产品物理性能研究(详见表)、化学/材料表征研究、生物学特性研究、稳定性研究。
临床评价部分
对于已纳入《免于临床评价医疗器械目录》的传统金属骨针,需要按照《列入免于进行临床评价医疗器械目录产品对比说明技术指导原则》开展评价;对于目录外金属骨针产品,还需要开展更为详细的临床评价,如增加超出范围产品的临床评价资料,同时建议重视真实世界证据,尽可能多地收集相应真实世界的临床使用数据,重视不良反应事件报告。
综上,实现以临床价值为导向的金属骨针产品设计开发,首先要求从事医疗器械生产、设计开发的企业熟悉现行的医疗器械生产、经营、注册等相关法律法规及指导文件,认真学习各类文件,正确运用指导文件,关注金属骨针类产品在临床使用中的痛点,坚持以临床价值为核心,重视风险管理,严格落实产品质量可靠、体系稳定的要求,进一步完善上市后的追踪反馈。未来,随着精准医疗与智能制造的融合,相信会有更多以临床需求为价值导向的骨针产品上市,进一步改善患者预后,审评体系也将同步革新以平衡创新与风险管理。
(作者单位:国家药监局医疗器械技术审评中心)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






