- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
3月份中美欧批准上市新药盘点
我国自主研发的三款新药在全球范围内首次获批上市
 |
|
 |
|
 |
|
□ 陈倩
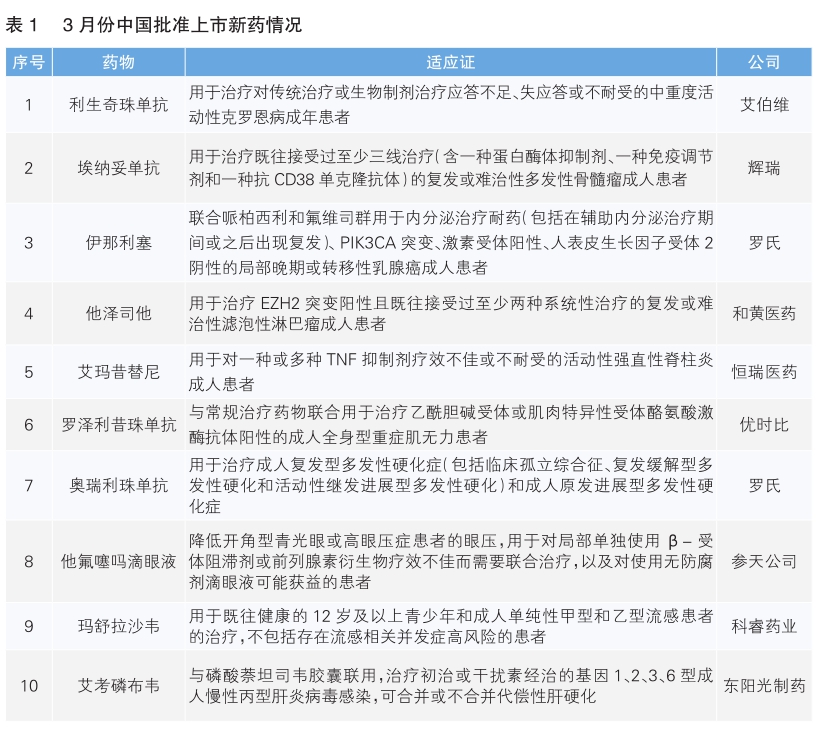
2025年3月中美欧批准上市的新药中,中国批准上市的新药数量最多,为10款;美国和欧盟各批准3款新药上市。
我国批准十款新药上市
3月份,我国批准10款新药上市(详见表1),其中根据Pharmadigger数据库,艾玛昔替尼、艾考磷布韦和玛舒拉沙韦均为全球范围内首次批准上市新药,且均为我国企业自主研发的新药。
利生奇珠单抗(商品名:喜开悦)是艾伯维研发的一种IL-23抑制剂,通过与IL-23 p19亚基结合来选择性阻断IL-23介导的一系列免疫炎症反应。本次获批包括利生奇珠单抗注射液和利生奇珠单抗(皮下注射)两种剂型,并配备随身给药器。在两项针对克罗恩病患者的诱导治疗研究和一项维持治疗研究中,与安慰剂相比,利生奇珠单抗在诱导和维持治疗阶段均显著改善内镜应答和临床缓解。该药最早于2019年3月在日本获批上市,用于治疗银屑病和银屑病关节炎;2019年4月获美国食品药品管理局(FDA)批准用于中重度银屑病患者。
埃纳妥单抗(商品名:易瑞欧)是辉瑞制药研发的一款同时靶向BCMA和CD3的双特异性抗体。本次获批基于全球关键Ⅱ期单臂临床研究MagnetisMM-3和中国Ⅰb/Ⅱ期临床研究MagnetisMM-8的数据。MagnetisMM-3研究显示,埃纳妥单抗在三线治疗后复发或难治性多发性骨髓瘤患者中展现出深度且持久的疗效,30个月仍获得持续缓解率约为60%。埃纳妥单抗已于2023年8月在美国获批上市。
伊那利塞(商品名:伊赫莱)是罗氏研发的一款口服、高选择性PI3Kα抑制剂,对PI3Kα的选择性和效力均高于其他亚型(PI3Kβ/δ/γ),并且能够特异性触发突变PI3Kα蛋白的降解。此次获批基于INAVO120研究,结果显示,在PIK3CA突变的HR+/HER2-局部晚期或转移性乳腺癌患者中,伊那利塞联合哌柏西利和氟维司群较安慰剂组显著延长中位无进展生存期。伊那利塞已于2024年11月在美国获批上市。
他泽司他(商品名:达唯珂)是和黄医药从Epizyme(益普生旗下公司)引进的全球首个EZH2甲基转移酶抑制剂。本次获批基于中国多中心Ⅱ期桥接临床研究及Epizyme海外临床数据。他泽司他已于2022年5月在海南博鳌乐城国际医疗旅游先行区获批使用,用于治疗特定上皮样肉瘤和滤泡性淋巴瘤患者。该药最早于2020年1月在美国获批上市。
艾玛昔替尼(商品名:艾速达)是恒瑞医药自主研发的高选择性口服 JAK1 抑制剂,通过阻断JAK-STAT信号传导通路,可直接或间接阻断多种强直性脊柱炎相关细胞因子信号转导,达到抑制炎症、缓解疾病的目的。本次获批基于Ⅱ/Ⅲ期临床研究SHR0302-302,结果显示,4mg剂量能显著改善非甾体抗炎药(NSAIDs)反应不足或禁忌的活动性强直性脊柱炎患者疾病活动度、体征及症状。
罗泽利昔珠单抗(商品名:优迪革)是优比时研发的一款靶向新生儿Fc受体的人源化IgG4单抗,可同时覆盖AChR阳性和MuSK阳性重症肌无力患者。其创新修饰结构能高效清除致病性IgG抗体,改善临床症状,且皮下注射仅需6分钟,便于长期管理。其关键Ⅲ期临床研究MycarinG显示,治疗43天后患者MG-ADL评分显著优于安慰剂组。罗泽利昔珠单抗最早于2023年6月在美国获批上市。
奥瑞利珠单抗(商品名:罗可适)是罗氏研发的靶向CD20阳性B细胞的单抗药物,每6个月静脉输注1次给药。两项针对复发型多发性硬化症患者的Ⅲ期临床研究显示,奥瑞利珠单抗较干扰素β-1a能显著降低患者年复发率和12周确认残疾进展比例。奥瑞利珠单抗此前已于2017年3月在美国获批上市。
他氟噻吗滴眼液(商品名:泰浦康)是参天公司研发的一款不含防腐剂的固定剂量复方滴眼液,该药含有两种对房水动力学有不同作用机制的有效成分,均能降低眼压。其中,他氟前列素的活性代谢产物(他氟前列素羧酸)是一种前列腺素FP受体激动剂,另一种成分马来酸噻吗洛尔是一种非选择性β受体阻滞剂。每日滴眼1次即可达到与联合用药相同的有效性和安全性,进一步提高了患者用药的便利性。他氟噻吗滴眼液此前已于2013年9月在日本获批上市。
玛舒拉沙韦(商品名:伊速达)是科睿药业自主研发的聚合酶酸性蛋白抑制剂,作用靶点是流感病毒RNA聚合酶酸性蛋白。该产品能更早干预病毒生命周期,直接阻碍成熟病毒的形成,患者全病程只需服药1次。其Ⅲ期临床研究结果显示,玛舒拉沙韦片可有效缩短流感症状缓解时间并快速清除病毒,同时具有良好的安全性和耐受性,耐药事件发生率低。
艾考磷布韦(商品名:东英贺)为东阳光制药自主研发的非结构蛋白5B抑制剂,艾考磷布韦和磷酸萘坦司的Ⅲ期临床试验结果显示,磷酸萘坦司100mg联合艾考磷布韦600mg在慢性丙肝患者中展现出显著的持续病毒学应答。其疗效与现有标准治疗方案(维帕他韦/索磷布韦、可洛派韦联合索磷布韦)相当,适用于泛基因型及基因1、2、3、6型患者,无论是否合并代偿性肝硬化。
美国批准三款新药上市
3月份,美国批准3款新药上市(详见表2)。根据Pharmadigger数据库,均为全球范围内首次批准。
Revakinagene taroretcel(商品名:Encelto)是Neurotech 制药基于其专有封装细胞疗法平台研发的细胞疗法。该疗法将表达睫状神经营养因子(CNTF)的同种异体视网膜色素上皮细胞封装于微型移植物中,植入眼内后可持续释放CNTF,从而延缓视网膜退化并潜在改善患者长期视力。移植物具有选择性通透外膜,既能允许营养物质进入和CNTF释放,又能保护移植细胞免受宿主免疫系统攻击,确保其长期存活与功能。此次批准基于两项Ⅲ期临床研究,结果显示,与对照组相比,接受Revakinagene taroretcel治疗的患者在植入后24个月内黄斑光感受器细胞丢失速度显著减缓。
Gepotidacin(商品名:Blujepa)是葛兰素史克研发的一款具有独特作用机制的口服抗生素。其通过均衡抑制两种Ⅱ型拓扑异构酶,对包括耐药菌株在内的多数目标病原体展现抗菌活性。本次获批基于关键Ⅲ期临床试验EAGLE-2和EAGLE-3的积极结果:在治疗≥12岁且体重≥40kg的单纯性尿路感染女性患者时,相较标准治疗药物呋喃妥因展现非劣效性。
Fitusiran(商品名:Qfitlia)是赛诺菲研发的一款通过皮下注射给药的靶向抗凝血酶的小干扰RNA疗法。其机制为降低抗凝血酶水平以促进凝血酶生成,重建止血平衡。采用50mg预充式注射笔给药,每年仅需注射6次。血友病A/B是罕见的遗传性出血性疾病,因凝血因子Ⅷ/Ⅸ缺乏导致凝血功能障碍,引发过度出血、自发性关节出血及关节损伤,严重影响患者生活质量。本次获批基于Ⅲ期临床试验ATLAS研究数据,结果显示,无论是否存在抑制剂,Fitusiran均能通过显著降低年化出血率,为患者提供具有临床意义的出血保护。
欧盟批准三款新药上市
3月份,欧盟批准3款新药上市(详见表3),根据Pharmadigger数据库,均非全球首批新药。
Eplontersen(商品名:Wainzua)是阿斯利康研发的一种每月使用1次的 RNA 靶向药物。其通过抑制转甲状腺素蛋白(TTR)的生成,精准靶向并减少肝脏源头的TTR蛋白产生。Eplontersen已于2023年12月在美国获批上市。
Imetelstat(商品名:Rytelo)是Geron公司研发的端粒酶抑制剂,临床前和临床试验数据显示,Imetelstat通过抑制端粒酶活性,可以抑制癌变干细胞和祖细胞不可控制的增殖,导致癌变细胞的凋亡,具有改变疾病进程的活性。Imetelstat此前已于2024年6月在美国获批上市。
Tisotumab vedotin(商品名:Tivdak)是辉瑞研发的一种抗体偶联药物 (ADC),由针对组织因子的人类单克隆抗体和辉瑞的 ADC 技术组成。该技术利用蛋白酶可裂解的连接体将微管破坏剂单甲基金圣草E共价连接到抗体上。Tisotumab vedotin已于2021年9月在美国获批上市。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






