- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
国家药品不良反应监测年度报告(2024年)(摘登)
 |
|
 |
|
 |
|
 |
|
 |
|
为全面反映2024年我国药品不良反应监测情况,提高安全用药水平,更好地保障公众用药安全,国家药品不良反应监测中心组织编撰《国家药品不良反应监测年度报告(2024年)》。
一、药品不良反应监测工作情况
2024年,国家药品不良反应监测中心在国家药监局的领导下,深入贯彻落实党中央、国务院决策部署,遵循“讲政治、强监管、保安全、促发展、惠民生”的工作思路,坚持“科学评价为基础、风险管理为主线、服务患者为中心”的警戒理念,以全面加强党的建设工作为引领,持续巩固药物警戒根基,不断提升技术支撑能力,积极开展警戒制度探索与交流合作,扎实推进药物警戒生态建设,为药品监管提供了强有力支撑,切实保护和促进公众健康。
一是统筹协同,持续巩固“一体两翼”格局。探索开展国家和省级中心一体化监测评价协作平台试点工作,开展各级药品不良反应监测机构技术人员业务培训、药品不良反应监测哨点培训、医疗机构培训、药品上市许可持有人(以下简称持有人)及经营企业培训等,促进药品不良反应监测能力提升。开展持有人药物警戒检查,不断压实药物警戒主体责任。
二是制度引领,稳步健全法规制度体系。持续推进《药品不良反应报告和监测管理办法》修订相关工作。研究起草《药品上市后安全性评价技术指导原则》等技术指南和规范性文件,指导持有人开展药物警戒工作,推动药物警戒制度建立健全。
三是风险防范,不断提升技术支撑能力。完成颠茄磺苄啶片、元胡止痛制剂、人血白蛋白等药品安全性评价,根据评价结果,国家药监局发布药品说明书修订公告33期、注销药品注册证书公告1期。开展药品预警信号审核,有效防控风险隐患,更好地保障公众用药安全。
四是开放合作,深度参与国际监管实践。作为世界卫生组织国际药物监测项目成员国,中国切实履行职责,与乌普萨拉监测中心建立信息交流和技术交流常态化机制,定期共享不良反应数据。参加国际人用药品注册技术协调会(ICH)、国际药品监管机构联盟(ICMRA)相关国际工作组会议,启动全球同步的ICH E2D(R1)指导原则监管机构征求意见程序,参与ICH M1的《MedDRA考虑要点伴随文件》等指南修订完善及发布。
五是共治共享,协同构建社会共治局面。发布《药物警戒快讯》12期,开展“全国药品安全宣传周——携手共建药品安全防线”活动,以国家药品不良反应监测中心网站、“中国药物警戒”微信公众号为平台,持续宣传安全用药知识,指导公众正确认识药品不良反应。
二、药品不良反应/事件报告情况
(一)报告总体情况
1.2024年度药品不良反应/事件报告情况
2024年全国药品不良反应监测网络收到《药品不良反应/事件报告表》259.7万份。1999年至2024年,全国药品不良反应监测网络累计收到《药品不良反应/事件报告表》2587.2万份。
2.新的和严重药品不良反应/事件报告情况
2024年全国药品不良反应监测网络收到新的和严重药品不良反应/事件报告90.9万份;新的和严重药品不良反应/事件报告占同期报告总数的35.0%。
2024年全国药品不良反应监测网络收到严重药品不良反应/事件报告45.4万份,严重药品不良反应/事件报告占同期报告总数的17.5%。
3.每百万人口平均报告情况
每百万人口平均报告数量是衡量一个国家药品不良反应监测工作水平的重要指标之一。2024年我国每百万人口平均报告数为1842份。
4.药品不良反应/事件县级报告比例
药品不良反应/事件县级报告比例是衡量我国药品不良反应监测工作均衡发展及覆盖程度的重要指标之一。2024年全国98.7%的县级地区报告了药品不良反应/事件。
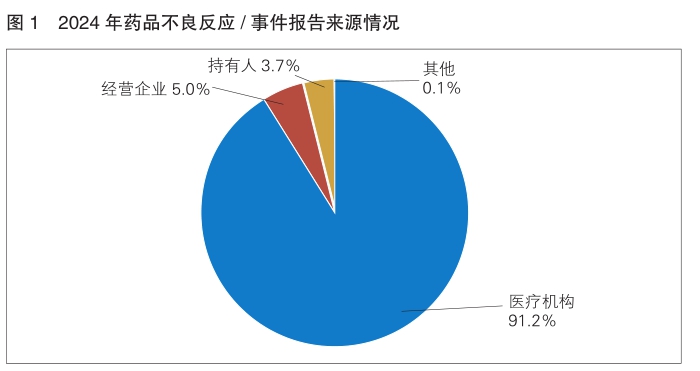
5.报告来源情况
持有人、经营企业和医疗机构是药品不良反应报告的责任单位。按照报告来源统计,2024年来自医疗机构的报告占91.2%,来自经营企业的报告占5.0%,来自持有人的报告占3.7%,来自其他报告者的报告占0.1%。(详见图1)
按照报告数量统计,2024年持有人报送药品不良反应/事件报告共计95052份,同比增长11.5%。其中,新的和严重药品不良反应/事件报告占持有人报告总数的53.7%。
6.报告人职业
按照报告人职业统计,医生占57.1%,药师占24.9%,护士占12.2%,其他职业占5.8%。
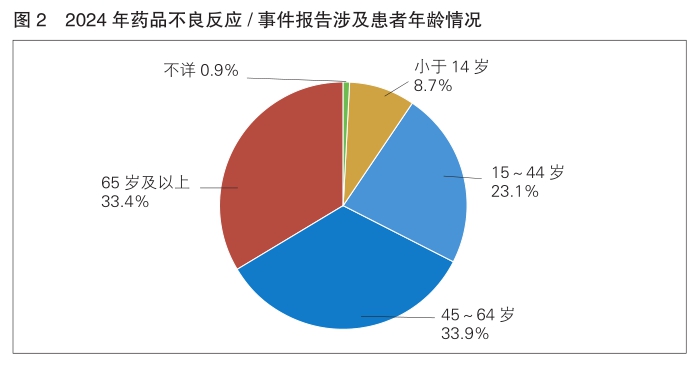
7.涉及患者情况
2024年药品不良反应/事件报告中,男女性别比为0.83∶1。从年龄分布看,14岁及以下儿童患者占8.7%,65岁及以上老年患者占33.4%。(详见图2)
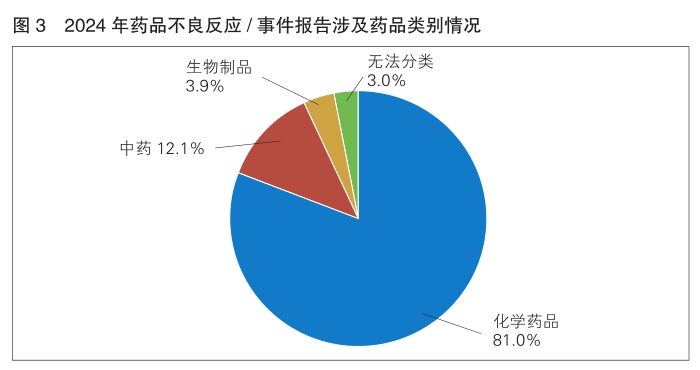
8.涉及药品情况
按照怀疑药品类别统计,化学药品占81.0%,中药占12.1%,生物制品占3.9%,无法分类占3.0%。(详见图3)
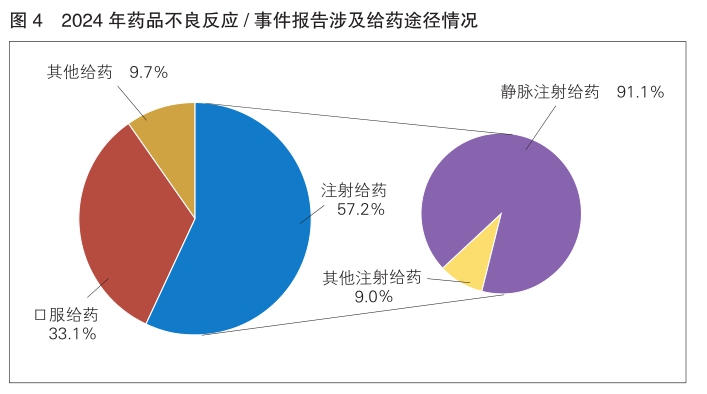
按照给药途径统计,2024年药品不良反应/事件报告中,注射给药占57.2%,口服给药占33.1%,其他给药途径占9.7%;注射给药中,静脉注射给药占91.0%,其他注射给药占9.0%。(详见图4)
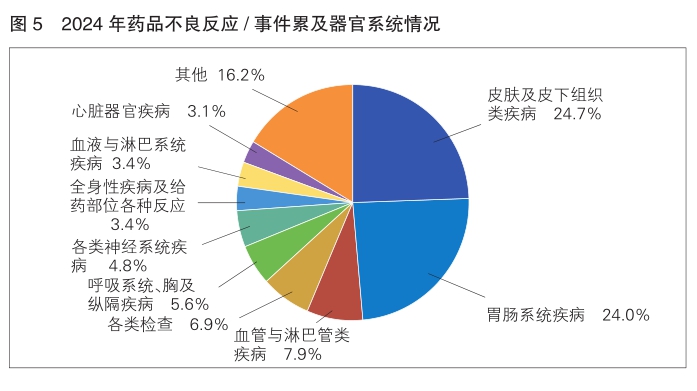
9.累及器官系统情况
2024年报告的药品不良反应/事件中,累及器官系统排名前3位依次为皮肤及皮下组织类疾病、胃肠系统疾病、血管与淋巴管类疾病。(详见图5)
(二)化学药品监测情况
2024年药品不良反应/事件报告中,涉及怀疑药品286.6万例次,其中化学药品占81.0%。2024年严重不良反应/事件报告涉及怀疑药品58.4万例次,其中化学药品占84.2%。
2024年化学药品不良反应/事件报告情况与2023年相比未出现显著变化,安全形势总体平稳可控。从不良反应涉及患者年龄看,应持续加强14岁及以下儿童、65岁及以上老年患者的安全用药管理。从化学药品类别上看,抗感染药报告数量仍居于首位,其占比呈现小幅上升,考虑与2024年该类药品的使用量有关。抗感染药的品种中排名前5位的药品与2023年无变化,左氧氟沙星仍位居首位。化学药品排名前20位的品种中,碘克沙醇为新增品种。
(三)中药监测情况
2024年药品不良反应/事件报告中,涉及怀疑药品286.6万例次,其中中药占12.1%;2024年严重不良反应/事件报告涉及怀疑药品58.4万例次,其中中药占5.1%。
与2023年相比,2024年中药不良反应/事件报告数略有增加,严重不良反应/事件报告占比为8.3%,低于总体药品不良反应/事件报告中严重不良反应/事件报告占比。从药品类别上看,活血化瘀药的报告数量依然居首位,占比略有上升。从总体情况看,2024年中药占总体不良反应/事件报告比例呈下降趋势,但仍需要注意安全用药。
(四)生物制品监测情况
2024年药品不良反应/事件报告中,涉及怀疑药品286.6万例次,其中生物制品占3.9%。2024年严重不良反应/事件报告涉及怀疑药品58.4万例次,其中生物制品占6.7%。
2024年生物制品不良反应/事件报告中,从涉及患者年龄看,14岁及以下儿童患者和65岁及以上老年患者占比同药品总体不良反应的情况基本一致。从生物制品类别上看,抗肿瘤药和免疫机能调节药居于首位,排名前5位的药品以单克隆抗体类抗肿瘤药居多。从报告来源上看,来自持有人报告占生物制品报告总数的23.4%,高于总体报告中持有人报告的占比。
(五)基本药物监测情况
2024年全国药品不良反应监测网络共收到《国家基本药物目录(2018年版)》收载品种的不良反应/事件报告116.6万份,其中严重报告22.3万份,占19.1%。报告涉及化学药品和生物制品占87.9%,中成药占12.1%。
《国家基本药物目录(2018年版)》化学药品和生物制品部分共417个(类)品种。2024年全国药品不良反应监测网络共收到国家基本药物化学药品和生物制品药品不良反应/事件报告111.0万例次,其中严重报告25.4万例次,占22.9%。
2024年国家基本药物化学药品和生物制品不良反应/事件报告按照药品类别统计,报告数量排名前5位的分别是抗微生物药、抗肿瘤药、心血管系统用药、激素及影响内分泌药、治疗精神障碍药;累及器官系统排名前5位的是皮肤及皮下组织类疾病、胃肠系统疾病、血管与淋巴管类疾病、各类检查及各类神经系统疾病。
《国家基本药物目录(2018年版)》中成药共涉及268个(类)品种。2024年全国药品不良反应监测网络共收到国家基本药物中成药不良反应/事件报告15.2万例次,其中严重报告13635例次,占9.0%。2024年国家基本药物7大类中成药中,药品不良反应/事件报告总数由多到少依次为内科用药、骨伤科用药、妇科用药、耳鼻喉科用药、外科用药、儿科用药、眼科用药。
监测数据表明,2024年国家基本药物监测总体情况基本保持平稳。
三、相关风险控制措施
根据2024年药品不良反应监测数据和分析评价结果,国家药监局对发现存在安全隐患的药品及时采取相应风险控制措施,以保障公众用药安全。
发布氨甲环酸注射制剂、元胡止痛制剂、破伤风人免疫球蛋白等药品说明书修订公告共33期,增加或完善39个(类)品种说明书中的警示语、不良反应、注意事项、禁忌等安全性信息。发布《国家药监局关于注销颠茄磺苄啶片药品注册证书的公告》。
发布《药物警戒快讯》12期,报道国外药品安全信息53条。
四、各论
根据药品不良反应监测结果以及公众关注情况,对抗感染药、心血管系统用药、儿童用药、生物制品抗肿瘤药、女性生殖系统用药不良反应监测情况进行分析,并提示安全风险如下。
(一)抗感染药不良反应监测情况
抗感染药是指具有杀灭或抑制各种病原微生物作用的化学药品,包括抗生素、合成抗菌药、抗真菌药、抗病毒药等,是临床应用最为广泛的药品类别之一,其不良反应/事件报告数量一直居于首位,是药品不良反应监测工作关注的重点。
2024年全国药品不良反应监测网络共收到抗感染药不良反应/事件报告80.0万份,其中严重报告14.0万份,占17.5%。抗感染药不良反应/事件报告数量占2024年总体报告数量的30.8%。
2024年抗感染药不良反应/事件报告占总体报告比例仍然居高不下,总体不良反应报告数量和严重不良反应报告数量均出现了较高的增长,但与总体报告不良反应/事件的增长趋势基本一致,提示抗感染药的用药风险仍需继续关注。
(二)心血管系统用药不良反应监测情况
心血管系统用药是指用于心脏疾病治疗、血管保护、血压和血脂调节的化学药品,包括降血压药、抗心绞痛药、血管活性药、抗动脉粥样硬化药、抗心律失常药、强心药、其他心血管系统药等。
2024年全国药品不良反应监测网络共收到心血管系统用药的不良反应/事件报告18.8万份,占总体报告的7.2%;其中严重报告20602份,占心血管系统用药的11.0%。
2024年心血管系统用药不良反应/事件报告中,降血压药为报告数最多的心血管类药物,这与高血压的治疗药物种类较多有关,还与高血压的发病率较高、用药人群基数大相关。严重不良反应/事件报告中,抗动脉粥样硬化药的报告构成比排名第一,其中阿托伐他汀报告的数量最多;不良反应表现最多的为肝功能异常、转氨酶升高、肝损伤等,提示医务人员和患者应关注这类药物的肝损害风险。
(三)儿童用药监测情况
2024年全国药品不良反应监测网络共收到14岁及以下儿童患者报告占总报告数8.7%。儿童患者严重报告占儿童患者总报告数15.8%。
2024年儿童患者药品不良反应/事件报告占报告总数的8.7%,严重报告占比(15.8%)低于总体情况(17.5%)。药物治疗是儿童防病治病的主要手段,因儿童生长期的生理特点,对药物具有特殊的反应性和敏感性,因此应持续关注儿童人群用药安全。
2024年统计数据显示,儿童患者用药在药品类别分布上,化学药品与2023年相同,抗感染药,电解质、酸碱平衡及营养药,呼吸系统用药的构成比高于该类别药品在化学药品总体报告中的构成比;中药排名居前的药品类别为清热剂、解表剂、止咳平喘剂、祛痰剂,这可能与儿童患者疾病谱使用以上药品较多及生理特点有关。
(四)生物制品抗肿瘤药不良反应监测情况
生物制品抗肿瘤药包括单克隆抗体、抗体偶联药物、细胞治疗药物等。2024年全国药品不良反应监测网络共收到生物制品抗肿瘤药不良反应/事件报告49364份,其中严重报告24315份,占49.3%。
2024年生物制品抗肿瘤药不良反应/事件报告数量约占总体报告数量的1.9%,严重报告占比高于2024年药品不良反应/事件总体情况。医务人员和患者均应重视可能的不良反应/事件,合理用药、适当预防、及时干预,尽量避免因严重不良反应/事件影响治疗。
(五)女性生殖系统用药不良反应监测情况
女性生殖系统用药是指用于女性避孕、保胎、月经不调、更年期综合征等治疗的化学药品。2024年全国药品不良反应监测网络共收到女性生殖系统用药的不良反应/事件报告3.3万份,占总体报告的1.3%;其中严重报告3877份,占女性生殖系统用药的11.7%。
2024年女性生殖系统用药不良反应/事件报告涉及50个药品品种,不良反应报告数量占总报告数的1.3%,与总体报告不良反应/事件的增长趋势基本一致。子宫收缩及引产药为报告数最多的类别,其次是避孕药、孕激素类及抗孕激素类药品。严重不良反应/事件报告中,报告数量排名靠前的药品类别和品种与总体报告基本一致。
五、有关说明
本年度报告中的数据来源于国家药品不良反应监测数据库中2024年1月1日至2024年12月31日各地区上报的数据。
与大多数国家一样,我国药品不良反应报告是通过自发报告系统收集并录入到数据库中的,存在自发报告系统的局限性,如漏报、填写不规范、信息不完善、无法计算不良反应发生率等。
每种药品不良反应/事件报告的数量受到该药品的使用量和不良反应发生率等诸多因素的影响,故药品不良反应/事件报告数量的多少不直接代表药品不良反应发生率的高低或者严重程度。
本年度报告完成时,其中一些严重报告尚在调查和评价的过程中,所有统计结果均为现阶段数据收集情况的真实反映,并不代表最终的评价结果。
本年度报告相关医学术语统计采用ICH监管活动医学词典(MedDRA)。MedDRA是在ICH主办下编制的标准化国际医学术语集,用于与人用医疗产品相关的监管沟通和数据评估。各类检查是MedDRA中的一项系统器官分类,包括有限定词(例如:升高、降低、异常、正常)和没有限定词的检查名称。
专业人士会分析药品与不良反应/事件的关联性,提取药品安全性风险信息,根据风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入安全性信息,更新药品如何安全使用的信息等。当药品的获益不再大于风险时,药品也会撤市。
本年度报告数据均来源于全国药品不良反应监测网络,不包含疫苗不良反应/事件的监测数据。目前,全国药品不良反应监测网络中的化学药品、中药、生物制品基于药品特点采用不同分类,相关表述存在不同。
(来源:国家药品不良反应监测中心网站)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






