- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
儿科用体外诊断试剂临床需求有待进一步满足
 |
|
□ 马佳男
根据《临床儿科学》中的定义,儿科的范围主要分为新生儿期(出生后至刚满28天)、婴儿期(出生后28天至1岁)、幼儿期(1岁至3岁)和小儿(3岁至18岁)。在儿科应用范围较广的体外诊断试剂主要为检测新生儿遗传病、儿童特有疾病和儿童成人均可使用的产品。
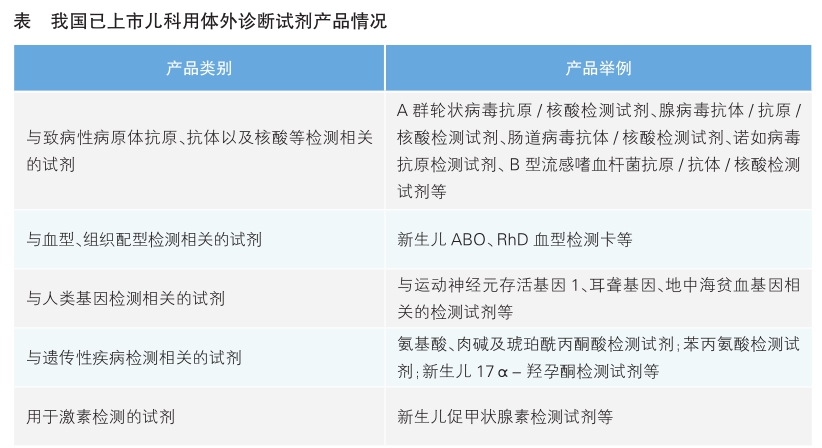
目前,我国已批准儿科使用的体外诊断试剂产品主要可分为5种(详见表)。
其中,一些儿科用体外诊断试剂的预期用途主要为新生儿遗传病的筛查。比如苯丙氨酸检测试剂用于遗传性苯丙酮尿症的筛查;氨基酸、肉碱及琥珀酰丙酮检测试剂用于对遗传代谢病进行筛查,相关的遗传代谢病主要包括氨基酸代谢障碍、脂肪酸氧化障碍和有机酸代谢障碍等;新生儿17α-羟孕酮检测试剂用于遗传性肾上腺皮质增生症的辅助诊断;葡萄糖-6-磷酸脱氢酶的检测用于先天性代谢疾病葡萄糖-6-磷酸脱氢酶缺乏症的早期诊断。
儿科常用的另一类体外诊断试剂是用于诊断多发于婴幼儿时期的疾病。比如:A群轮状病毒抗原/核酸检测试剂、腺病毒抗体/抗原/核酸检测试剂、诺如病毒抗原检测试剂可用于婴幼儿腹泻时的检测;新生儿ABO、RhD血型检测卡用于确定新生儿ABO、RhD抗原及新生儿红细胞是否在体内被不完全抗体致敏;运动神经元存活基因1外显子缺失检测试剂用于脊髓性肌萎缩症的辅助诊断。
目前,临床上用于检测罕见病(如单基因病)、遗传病等方面的儿科用体外诊断试剂对疾病的种类涵盖不够全面,存在较大的未满足的临床需求。儿科人群的生物学特征、儿科用体外诊断试剂的适应证和临床使用风险等,对产品的技术开发、验证提出了更多要求。除了研发成本较高,临床试验方面也面临入组、知情同意和伦理审查要求等复杂问题。
儿科用体外诊断试剂产品的申请人,应充分利用现行法规中对于儿科用体外诊断试剂的优先政策,如《医疗器械优先审批程序》中提到对于“专用于儿童,且具有明显临床优势的医疗器械”实施优先审批等。同时,申请人也应关注医疗机构自研试剂试点相关政策的发布,以更好地满足儿科患者的临床需求。
(作者单位:国家药监局医疗器械技术审评检查长三角分中心)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






