- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
2024年度医疗器械注册工作报告
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
2024年,国家药监局以习近平新时代中国特色社会主义思想为指导,全面贯彻党的二十大和二十届二中、三中全会精神,按照“讲政治、强监管、保安全、促发展、惠民生”的工作思路,全面深化医疗器械审评审批制度改革,健全支持医疗器械创新发展机制,强化医疗器械注册质量管理,夯实医疗器械监管基础,加强监管能力建设,推动产业创新高质量发展。
一、医疗器械注册工作情况
(一)医疗器械监管法治建设稳步推进
2024年,国家药监局通过深入调研论证,广泛征求意见,完成《中华人民共和国医疗器械管理法(草案送审稿)》,将为加快推进我国从制械大国向制械强国跨越提供更加坚实的法治保障。印发《医疗器械临床试验机构监督检查办法(试行)》《医疗器械临床试验机构监督检查要点及判定原则(试行)》,强化临床试验规范化管理。会同国家卫生健康委发布《医疗机构临床急需医疗器械临时进口使用管理要求》,进一步满足特殊情况下临床诊疗救治急需。研究修订《医疗器械临床试验项目检查要点及判定原则》,强化临床试验项目管理。研究修订《关于进口医疗器械产品在中国境内企业生产有关事项的公告》,进一步鼓励跨国企业在中国境内生产。
(二)创新医疗器械获批数量持续增长
2024年,国家药监局共批准创新医疗器械65个,优先审批医疗器械8个,创新医疗器械批准数量连续两年维持高位,获批产品的质量和数量取得双丰收。支气管导航控制系统、体外心室辅助设备、肾动脉射频消融仪等多款高端医疗器械上市,覆盖手术机器人、心肺支持辅助系统、人工智能等多领域。其中,心脏内超声成像系统、融合超声和光声成像技术的双模态超声成像产品、基于多病种算法设计的眼底图像辅助诊断软件、小型化集成型单室质子治疗系统等产品在国内首次获批,不仅为患者提供了更多治疗选择,还有效提升了临床手术的安全性和成功率,更好地满足人民群众使用高水平、高质量医疗器械的需求。选取医用机器人、人工智能医疗器械、高端医学影像设备和新型生物材料4个重点领域,研究全链条集成创新支持政策。3个猴痘病毒检测试剂获准注册,全力服务保障重大公共卫生需求。成立高端医疗装备创新合作平台,汇聚政产学研医各领域优势资源,加强颠覆性、原创性技术研究和科技成果转化。推进第一批人工智能医疗器械创新任务、生物医用材料创新任务揭榜挂帅工作,确定106个人工智能医疗器械优胜项目。
(三)国家重大区域战略稳步落实
大力支持粤港澳大湾区、海南自贸港、福建等重点区域建设。批准肾动脉射频消融仪等3个海南临床真实世界应用试点产品上市,截至2024年底,累计批准产品12个,惠及更多患者。指导粤港澳大湾区使用48种、158批次港澳地区已上市的医疗器械,服务区域诊疗需要。批复福建省药监局对台湾地区产第一类医疗器械实施备案,支持福建探索海峡两岸融合发展新路。指导出台《北京市促进临床急需药械临时进口工作实施方案(试行)》《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》,规范区域内临床急需医疗器械管理。
(四)医疗器械注册备案管理不断规范
开展“进省局、进企业、进医院,促创新、促规范、促提升”的“三进三促”专题调研,以点带面维护医疗器械注册备案工作秩序。组织召开医疗器械注册管理片区工作座谈会,分析研讨注册管理工作面临的形势和挑战。落实第二类医疗器械首个产品注册管理机制。召开第一类医疗器械备案管理工作现场会、第一类医疗器械备案工作联系点座谈会,细化工作指导,督促建立完善备案管理工作机制。各级药监部门对第二类医疗器械注册信息和第一类产品备案信息实行月度、季度主动公开,接受社会监督。
(五)注册管理风险防控机制逐步完善
每季度召开注册备案问题风险会商会,会商研判管理类别或属性问题、规范性问题。临床试验检查力度持续加大,截至2024年底,临床试验机构备案共计1498个。各省级药品监管部门共开展机构检查885家次,比上年增加55.5%,占备案机构数量的59.1%。国家药监局分两批对50个在审品种开展临床试验现场检查和产品真实性核查,检查数量比2023年增加66%,有力发挥监督抽查震慑作用。
(六)医疗器械审评审批能力加速提升
组织开展省级医疗器械审评人员和审评机构能力评价,推动医疗器械审评审批能力提升。举办医疗器械注册法规与注册管理实务培训、12期线上和6期线下第二类医疗器械审评实训、临床试验监管和检查人员专题培训、体外诊断试剂分类网络专题培训等,系统内外累计培训11300人次。发挥官方网站和微信公众号信息发布平台作用,持续更新“器审云课堂”,已收录课程431个,不断提升政务服务水平。全年发布120项指导原则。推进中国药品监管科学行动计划第三批重点项目。
(七)医疗器械标准体系建设不断夯实
2024年,下达行业标准制修订计划项目100项,通过快速程序批准2项采用脑机接口技术的医疗器械相关行业标准立项,鼓励相关产品研发创新。批准发布医疗器械行业标准90项。2024年获批国家标准制修订项目33项,发布医疗器械国家标准49项。现行有效医疗器械标准2023项(国家标准296项、行业标准1727项)。统筹推进新版GB 9706系列标准实施。深入参与国际标准化工作,《人工智能医疗器械 肺部影像辅助分析软件 算法性能测试方法》等6项国际标准有序推进,我国主导制定的ISO 7151:2024《外科器械 非切割铰接器械通用要求和试验方法》国际标准获批发布;新增国际标准化组织注册专家144人,1名中国标准化专家获任ISO和IEC国际标准组织联络员,标准国际化进程稳步推进。
(八)医疗器械分类管理进一步细化
修订发布《体外诊断试剂分类目录》,设立一级产品类别25个,二级产品类别1852个,同步发布配套实施通告及解读,进一步强化体外诊断试剂分类指导,支持体外诊断试剂创新发展。修订发布《关于规范医疗器械产品分类界定工作的公告》,优化分类界定工作流程,提升分类界定工作质量和效率。针对近视控制、弱视治疗类产品,应用纳米材料的医疗器械等热点产品研究起草分类界定指导原则,加强交叉管理产品研究。启动《医疗器械分类目录》与通用名命名对应研究,推进衔接整合。选取部分植入类医疗器械开展医疗器械通用名称与医保通用名关联映射研究,强化三医联动。
(九)监管科学研究深入推进
组织推进新一代基因测序产品评价方法研究、数字疗法医疗器械质量评价方法研究等9个医疗器械上市前重点项目45个子项目研究工作,强化督促指导。加快推进全国药品监管科学重点实验室建设,开展脑机接口系统柔性电极安全性评价等12项检验方法研究。组织开展医疗器械企业合规能力建设探索研究,引导企业构建质量合规体系,探索建立医疗器械质量合规管理能力评估机制以及评估结果应用的可行路径。
(十)国际交流合作取得实质性进展
着力推动全球医疗器械法规协调会(GHWP)发展,积极履行主席义务,设立战略咨询委员会、组建能力建设委员会,成立审评互信实践特别工作组,进一步增进组织活力;已完成10项指南文件的制修订,为组织发展夯实支撑;在广东省广州市创立全球首家GHWP医疗器械培训学院,加快提升成员国家和地区的监管能力。积极参加国际医疗器械监管者论坛(IMDRF),跟进国际医疗器械监管最新进展,部署新项目研究,加快国际规则转化实施。
二、医疗器械注册申请受理情况
2024年,国家药监局依职责共受理医疗器械首次注册、延续注册和变更注册申请共计13828项,与2023年相比增加4.3%。
(一)整体情况
受理境内第三类医疗器械注册申请7600项,受理进口医疗器械注册申请6228项。
按注册品种区分,医疗器械注册申请10271项,体外诊断试剂注册申请3557项。
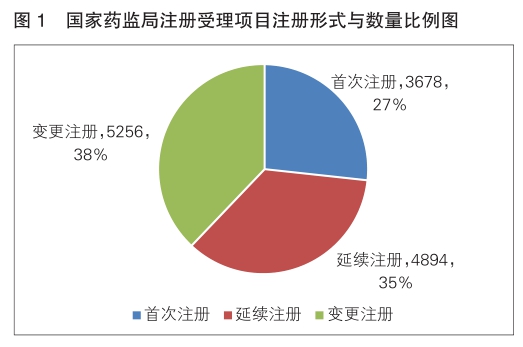
按注册形式区分,首次注册申请3678项,占全部医疗器械注册申请的27%;延续注册申请4894项,占全部医疗器械注册申请的35%;变更注册申请5256项,占全部医疗器械注册申请的38%。注册形式与数量比例情况见图1。
(二)分项情况
1.境内第三类医疗器械注册受理情况
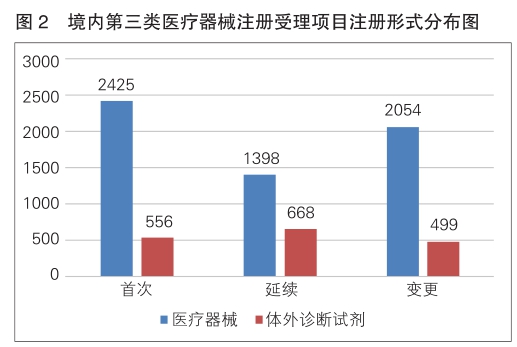
境内第三类医疗器械注册受理共7600项,与2023年相比增加7%。其中,医疗器械注册申请5877项,体外诊断试剂注册申请1723项。
从注册形式看,首次注册2981项,占全部境内第三类医疗器械注册申请数量的39.2%;延续注册2066项,占全部境内第三类医疗器械注册申请数量的27.2%;变更注册2553项,占全部境内第三类医疗器械注册申请数量的33.6%。注册形式分布情况见图2。
2.进口第二类医疗器械注册受理情况
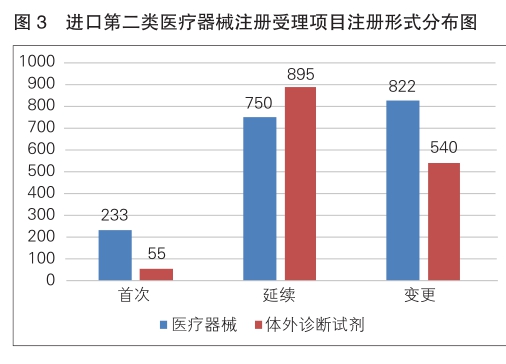
进口第二类医疗器械注册受理共3295项,与2023年相比增加8.5%。其中,医疗器械注册申请1805项,体外诊断试剂注册申请1490项。
从注册形式看,首次注册288项,占全部进口第二类医疗器械注册申请数量的8.7%;延续注册1645项,占全部进口第二类医疗器械注册申请数量的49.9%;变更注册1362项,占全部进口第二类医疗器械注册申请数量的41.4%。注册形式分布情况见图3。
3.进口第三类医疗器械注册受理情况
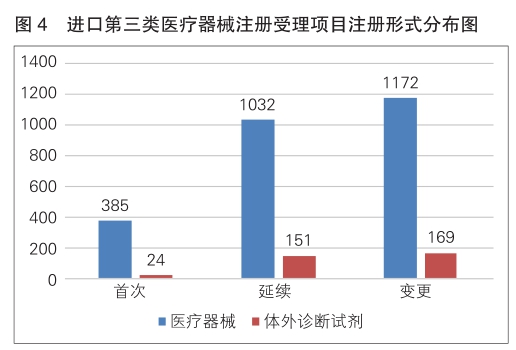
进口第三类医疗器械注册受理共2933项,与2023年相比减少5.9%。其中,医疗器械注册申请2589项,体外诊断试剂注册申请344项。
从注册形式看,首次注册409项,占全部进口第三类医疗器械注册申请数量的14.0%;延续注册1183项,占全部进口第三类医疗器械注册申请数量的40.3%;变更注册1341项,占全部进口第三类医疗器械注册申请数量的45.7%。注册形式分布情况见图4。
三、医疗器械注册审批情况
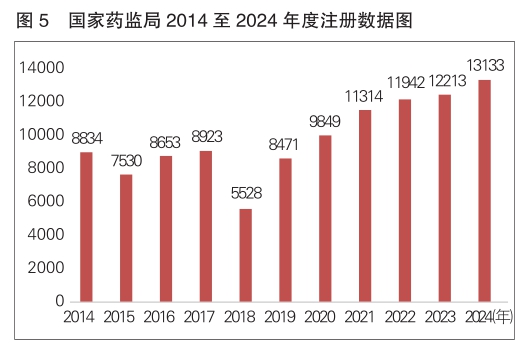
2024年,国家药监局共批准医疗器械首次注册、延续注册和变更注册13133项,与2023年相比注册批准总数量增长7.5%。
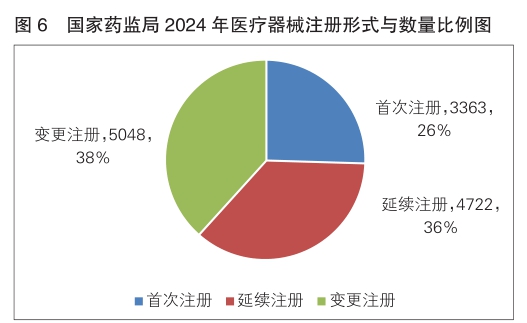
其中,首次注册3363项,与2023年相比大幅增加23.3%;延续注册4722项,与2023年相比减少1.4%,连续三年减少;变更注册5048项,与2023年相比增加7.5%。
2024年,企业自行撤回首次注册申请、自行注销注册证书380项。
近11年国家药监局批准医疗器械注册情况见图5。
(一)整体情况
2024年,国家药监局批准境内第三类医疗器械注册6886项,与2023年相比增加11.9%;进口医疗器械6247项,与2023年相比增加3.1%。
按照注册品种区分,医疗器械9695项,占全部医疗器械注册数量的73.8%;体外诊断试剂3438项,占全部医疗器械注册数量的26.2%。
按照注册形式区分,首次注册3363项,占全部医疗器械注册数量的26%;延续注册4722项,占全部医疗器械注册数量的36%;变更注册5048项,占全部医疗器械注册数量的38%。注册形式比例情况见图6。
(二)分项情况
1.境内第三类医疗器械注册审批情况
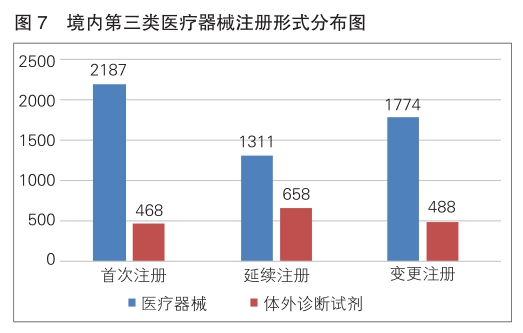
境内第三类医疗器械注册6886项。其中,医疗器械5272项,体外诊断试剂1614项。
从注册形式看,首次注册2655项,占全部境内第三类医疗器械注册数量的38.6%;延续注册1969项,占全部境内第三类医疗器械注册数量的28.6%;变更注册2262项,占全部境内第三类医疗器械注册数量的32.8%。注册形式分布情况见图7。
2.进口第二类医疗器械注册审批情况
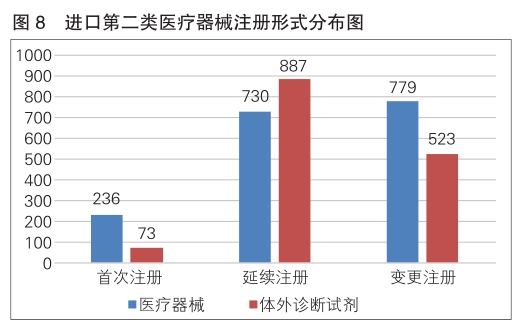
进口第二类医疗器械3228项。其中,医疗器械注册1745项,体外诊断试剂注册1483项。
从注册形式看,首次注册309项,占全部进口第二类医疗器械注册数量的9.6%;延续注册1617项,占全部进口第二类医疗器械注册数量的50.1%;变更注册1302项,占全部进口第二类医疗器械注册数量的40.3%。注册形式分布情况见图8。
3.进口第三类医疗器械注册审批情况
进口第三类医疗器械注册3019项。其中,医疗器械注册2678项,体外诊断试剂注册341项。
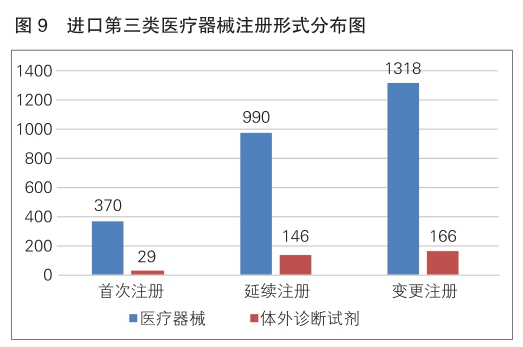
从注册形式看,首次注册399项,占全部进口第三类医疗器械注册数量的13.2%;延续注册1136项,占全部进口第三类医疗器械注册数量的37.6%;变更注册1484项,占全部进口第三类医疗器械注册数量的49.2%。注册形式分布情况见图9。
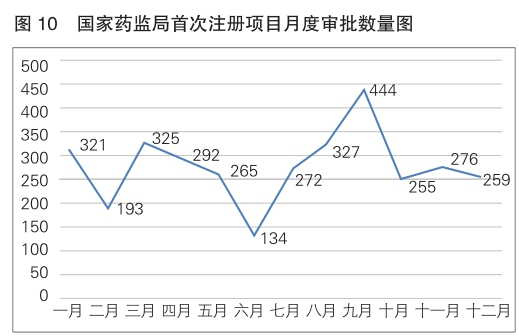
(三)首次注册项目月度审批情况
2024年,国家药监局首次注册月度审批情况见图10。
(四)具体批准品种种类分析
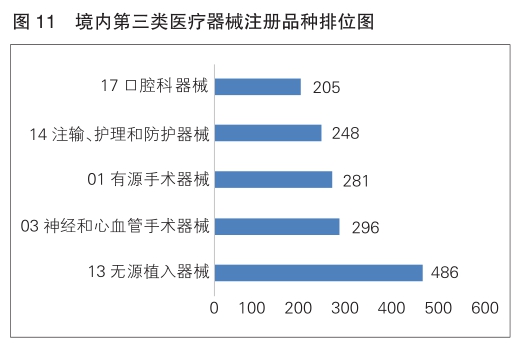
注册的境内第三类医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中18个子目录的产品。
注册数量前五位的境内第三类医疗器械是:无源植入器械,神经和心血管手术器械,有源手术器械,注输、护理和防护器械,口腔科器械。与2023年相比,有源手术器械超过注输、护理和防护器械,注册数量同比增加61.5%;口腔科器械超过医用成像器械进入前五位;其他品类注册数量也有所增加,如注输、护理和防护器械增加17%,神经和心血管手术器械增加8.4%,无源植入器械增加2.3%。
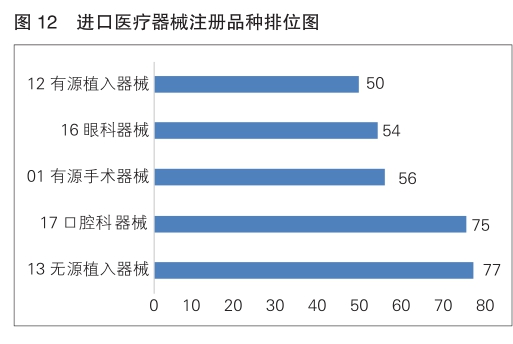
注册的进口医疗器械,除体外诊断试剂外,共涉及《医疗器械分类目录》中21个子目录的产品。
注册数量前五位的进口医疗器械是:无源植入器械、口腔科器械、有源手术器械、眼科器械、有源植入器械,与2023年相比,变化较大,有源植入器械超过医用成像器械进入前五位,有源手术器械超过眼科器械,注册数量同比增加24.4%,其他品类注册数量略有增加。
(下转7版)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






