- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
5月份美国Clinicaltrial数据库临床试验数据显示——
内分泌系统疾病药物研发热度提升
 |
|
 |
|
□ 陈宇哲
根据美国Clinicaltrial数据库数据,2024年5月份,全球新增由企业资本主导的临床试验总数为663项,新开临床试验数量明显下降,较4月份下降5.56%。单月新增临床试验数量仍高于2023年同期水平,同比增长1.53%。
值得关注的是,中国药企正大天晴进入全球新开临床试验数量排名前十的企业榜单,排名第七位,且增幅为第一。
新开临床试验整体情况
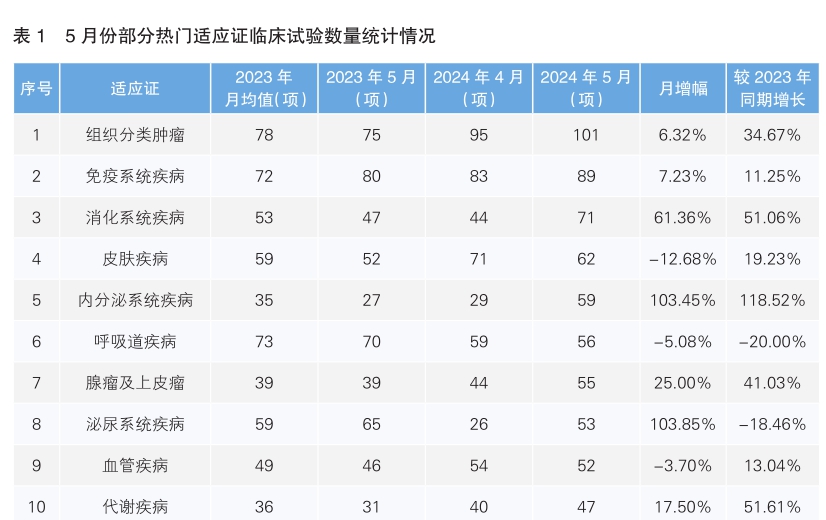
从5月份新增临床试验热门适应证领域来看,组织分类肿瘤仍为最主要的热门研发领域,新开临床试验数量为101项,环比上升6.32%;其次为免疫系统疾病,环比增长7.23%。月增幅最高的热门适应证为泌尿系统疾病,单月增幅为103.85%。月降幅最大的热门适应证为皮肤疾病,单月降幅为12.68%。同比增幅最为显著的为内分泌疾病,增长率为118.52%。(详见表1)
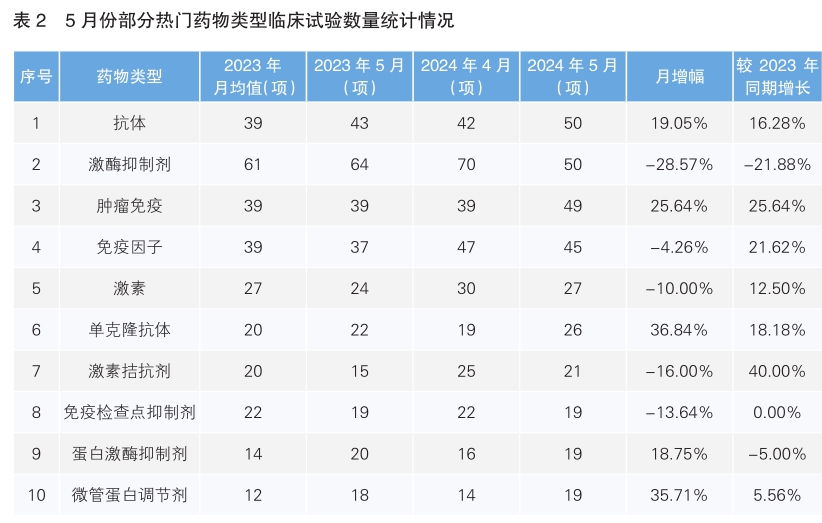
对新开临床试验药物类型进行统计后发现,5月份最为热门的药物类型为抗体,首次超过了激酶抑制剂,环比上升了19.05%,同比增长了16.28%;其次为激酶抑制剂,环比降幅为28.57%,同比下降了21.88%。月增幅最高的药物类型为单克隆抗体,月增幅为36.84%,同比增长18.18%。同比增幅最高的药物类型是激素拮抗剂,同比上升了40%。(详见表2)
对新开临床试验的申请国家和地区进行统计后发现,当月美国仍为临床试验开展最为主要的国家,数量环比下降了11.59%;其次是中国,环比下降了19.79%。
相较于4月份,除法国外,热门国家和地区新开临床试验数量均下降;其中澳大利亚的月降幅最高,为40.48%。
正大天晴新开试验数量环比翻倍
5月份,新开临床试验数量最多的企业(机构)是阿斯利康和辉瑞,申报数量均为14项;其次为艾伯维,新开临床试验数量为13项。
全球新开临床试验数量排名前十的企业中,环比增幅最大的是正大天晴,新开临床试验数量翻倍,从上个月的4项增加至本月的8项,这也是今年正大天晴最高的排名记录。
正大天晴本月新增的8项临床试验中,有两项为Ⅲ期临床试验,此外还有两项Ⅱ期、一项Ⅰ/Ⅱ期和三项Ⅰ期临床试验。
其中,一项Ⅲ期临床试验的适应证为急性T淋巴白血病(NCT06434467),试验药物为奈拉滨(Nelarabine)。奈拉滨是一种核苷代谢抑制剂,用于治疗接受至少两种化疗方案治疗后无反应或复发的T细胞急性淋巴细胞白血病和T细胞母细胞淋巴瘤。这是一项单臂、开放标签、多中心的Ⅲ期临床研究,包括83名受试者(35名成人和48名儿童),旨在评估奈拉滨注射剂治疗患有难治性或复发性T淋巴母细胞白血病和T淋巴母细胞淋巴瘤的成人和儿童后两个周期内的复合完全缓解率(CCR)。奈拉滨原研药于2005年获美国食品药品管理局(FDA)批准上市。
另一项Ⅲ期临床试验的适应证为血管扩张性休克(NCT06351150),试验药物为血管紧张素Ⅱ注射液。原研产品血管紧张素Ⅱ注射液(商品名:Giapreza)是由La Jolla Pharmaceutical公司开发的一种血管收缩剂,用于提升成人患有脓毒性或其他分布性休克的血压,2017年12月经美国FDA批准上市。《拯救脓毒症运动(Surviving Sepsis Campaign, SSC):脓毒症与感染性休克治疗国际指南2021版》将血管紧张素Ⅱ作为感染性休克的治疗手段。血管紧张素与加压素相比,升压机制更明确,且剂量调整范围广,不诱导一氧化氮生成。作为人体内源性激素,血管紧张素Ⅱ具有更好的安全性。目前,Giapreza暂未在中国上市,正大天晴研发的TQG3902注射液为Giapreza的仿制产品,按照3类化学药品申报注册。体外研究表明,TQG3902注射液受体结合活性、氨基酸序列结构与原研药一致。
一项Ⅱ期临床试验的适应证为慢性移植物抗宿主病(NCT06300320),试验药物为TQ05105(Rovadicitinib)。TQ05105是正大天晴自主研发的一款具有全新化学结构的JAK/ ROCK抑制剂。体外试验结果显示,TQ05105能够有效抑制JAK家族激酶活性及ROCK激酶活性,能显著抑制细胞中STAT3和STAT5的磷酸化水平,从而抑制JAK/STAT信号通路传导作用,进而发挥抗肿瘤活性。
另一项Ⅱ期临床试验的适应证为嗜铬细胞瘤(NCT06429397),试验药物为盐酸安罗替尼(Anlotinib)联用派安普利单抗注射液(Penpulimab)。盐酸安罗替尼是一种小分子多靶点酪氨酸激酶抑制剂,能有效抑制VEGFR、PDGFR、FGFR、c-Kit等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的作用,于2018年获国家药监局批准上市。派安普利单抗注射液于2021年8月获国家药监局批准上市,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤成人患者的治疗。作为第五个上市的国产PD-1药物,派安普利单抗差异化优势明显,是全球唯一采用IgG1亚型并对Fc段改造的新型PD-1单抗。
一项Ⅰ/Ⅱ期临床试验的适应证为骨髓纤维化(NCT06245941),试验药物为TQ05105。
三项Ⅰ期临床试验中有两项适应证为晚期肿瘤,一项为慢性阻塞性肺病。
其中一项晚期肿瘤的试验药物为TQB3107(NCT06413953)。公开资料显示,TQB3107是一种蛋白抑制剂,可诱导细胞凋亡并抑制多种肿瘤细胞的增殖。另一项晚期肿瘤的试验药物为TQB2928(NCT06297642)。TQB2928是一种有前途的新分子实体,可介导 CD47 和 SIRPα(信号调节蛋白 Alpha)的阻断并增强巨噬细胞对癌细胞的吞噬作用。
最后一项非肿瘤的Ⅰ期临床试验的适应证为慢性阻塞性肺疾病,试验药物为TQC3927(NCT06408285)。TQC3927吸入粉雾剂是正大天晴第二款吸入制剂创新药,专门设计用于通过呼吸道将药物直接递送到目标部位,发挥局部或全身治疗作用。这种制剂的优点在于起效迅速、所需药量小、不良反应少,并且使用方便。公司的首款吸入制剂创新药吸入用TQC3721混悬液,已进入Ⅱ期临床试验阶段,主要针对中重度慢性阻塞性肺病。
(数据来源于美国Clinicaltrial数据库,标签间存在统计重复,统计时间为2024年6月23日)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






