- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
新材料新技术为前交叉韧带重建提供更多选择
 |
|
□ 杨洁莹
前交叉韧带是膝关节内连接股骨与胫骨的重要解剖结构,其主要作用是限制胫骨向前过度移位,与膝关节内其他结构共同维持膝关节的稳定性,并使人体完成各种复杂和高难度的下肢动作。当胫骨过度前后移位、膝关节过度内外旋或过度屈伸时,都可能导致韧带起止点或韧带本身发生撕裂和断裂。前交叉韧带损伤与患者膝关节解剖形态、性别、遗传因素以及神经肌肉功能等因素有关。
前交叉韧带损伤分接触性和非接触性两种,其中大多数是由非接触性机制引起的,如在跑步或跳跃时突然减速和改变方向而引起的损伤。目前,国内外用于前交叉韧带重建的移植物主要包括自体移植物、同种异体移植物、人工韧带等。
自体移植物
自体移植物是国内外诊疗指南中重建前交叉韧带的首选方式。自体移植物的优势在于不会出现排异反应或传染性疾病,且费用低、愈合快,不存在消毒和储存的问题。
当前自体移植物运用最广泛的是骨-髌腱-骨、腘绳肌和股四头肌腱等。然而,采用自体肌腱也存在一系列的问题,如采用骨-髌腱-骨导致膝前疼痛、髌韧带缩短、髌骨骨折,获取自体腘绳肌可能引起隐神经损伤等,故近年来催生了一系列的同种异体移植物、高分子人工韧带等产品面世。
同种异体移植物
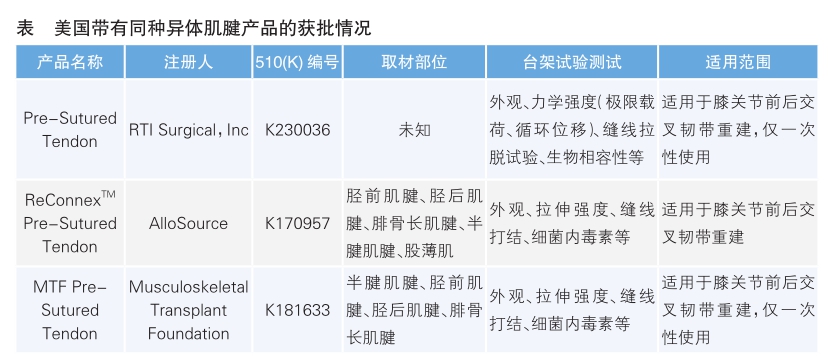
同种异体移植物具有无取腱处并发症、手术时间短、无术肢伸屈膝机制改变、关节纤维化风险低等优点。截至目前,我国已有3款同种异体肌腱产品获批上市,临床用于前交叉韧带重建手术。而在美国,同种异体移植物的研发需要满足美国组织库协会(AATB)的相关要求,通过对美国食品药品管理局(FDA)数据库的检索,未见用于前交叉韧带重建的同种异体移植物单独被审批通过,仅能查询到带有预编缝线的同种异体肌腱产品,这些产品的肌腱多由美国非营利性组织库,如LifeNet Health、MTF Biologics、AlloSource等,或营利性组织库,如LifeCell、Osteotech、Regeneration Technologies,Inc.等所提供。目前为止,已批准用于前交叉韧带重建的带有同种异体肌腱的产品主要通过510(K)途径进行申报(详见表)。
美国对于同种异体肌腱的来源监管同我国类似,都需对供体的血清进行一系列检测,如对艾滋病病毒抗体、乙型肝炎病毒表面抗原、丙型肝炎病毒表面抗原、梅毒等的检测。资料显示,上述3款产品还对乙肝核心抗体、人类T嗜淋巴细胞病毒抗体(Ⅰ/Ⅱ)进行了检测,并都提供了尸体试验来验证产品对于交叉韧带重建的可行性。
高分子人工韧带
由于自体肌腱从患者自身获取,存在一定创伤且来源有限,而同种异体肌腱存在免疫排异等风险,且肌腱移植物与骨关节相关结构需经历长达2年的“再韧带化”过程。因此,高分子人工韧带产品的研发应用成了一种新尝试。据文献报道,境外上市的用于前交叉韧带重建的高分子人工韧带主要包括原材料为聚四氟乙烯的Gore-Tex韧带、聚丙烯为基材的3M Kennedy韧带增强装置(LAD)以及Stryker Dacron人工韧带假体。然而,研究显示,采用上述人工韧带产品进行重建前交叉韧带术后,长期随访的结果较差,较常发生反应性滑膜炎、人工韧带固定不稳甚至断裂、磨损后出现纤维颗粒等并发症。
国内对于采用高分子人工韧带进行前交叉韧带重建的相关共识表明,聚对苯二甲酸乙二醇酯老化对于前交叉韧带重建远期疗效的影响仍不明确,且依然存在出现滑膜炎、关节感染的风险。因此,在获批上市的“人工韧带及附件”等产品的审评意见中,要求需警惕永久植入体内后反复受力断裂的风险。对前交叉韧带使用有长期高要求的患者,医生需要综合对比不同移植物的优缺点,选择恰当的移植物并且长期坚持追踪其安全性、有效性。
组织工程人工韧带
理想的组织工程韧带支架材料应具有良好的生物力学性能和生物相容性,且具有适宜的降解速度。据文献报道,目前用于组织工程人工韧带的支架材料有天然生物材料(如胶原、蚕丝、异基因细胞外基质)以及合成可降解材料(如聚羟基乙酸、聚乳酸、聚乙交酯丙交酯)两大类。其中,胶原纤维是构成韧带的基本结构物质,具有较高的抗张强度。黏膜下层是一种天然、无细胞、可生物降解的细胞外胶原基质,这种无细胞基质主要由螺旋交织的Ⅰ型和Ⅲ型胶原组成,可通过小肠黏膜下层、膀胱和输尿管制取。
经检索,目前有一款该类组织工程人工韧带在美国获批上市。2020年6月,Miach Orthopaedics公司通过De Novo途径上市了一款可吸收前交叉韧带修复产品BEAR Implant。该产品由牛细胞外基质胶原组成,适用于14岁及以上膝关节前交叉韧带完全断裂的骨骼成熟患者。同时,患者必须有一个能连接到胫骨可进行修复的膝关节前交叉韧带残端。产品使用时,需在手术过程中取10ml自体血,BEAR Implant将自体血稳定在撕裂的韧带两端的缝隙中,经过8周左右时间,该处就可形成纤维血管组织。
通过美国FDA披露的信息可知,该产品开展了一系列台架试验,如生物化学表征包含了蛋白质含量、DNA含量、磷脂、蛋白活性、糖胺多糖含量、电泳法蛋白质表征和细菌内毒素等,其他性能还包括密度、血液吸收量、克氏针膝盖功能性测试等。动物试验评估了8周时间内器械吸收的组织切片和韧带愈合的生物力学性能等。
此外,该产品同时开展了临床试验研究,包含一项可行性研究和关键性研究。其中关键性研究为随机(2∶1)对照非劣效试验。其对照组选用腘绳肌或骨-肌腱-骨,总样本量为109人。术后,受试者接受规定的物理治疗方案,并在第1~2周,第6周,第3、6、12和24个月时进行随访。主要有效性评价指标为术后2年的国际膝关节文献委员会(IKDC)评估表评分和KT测量系统测量的AP膝关节松弛度结果。次要有效性指标包括6个月/12个月通过手持式测力计测定腘绳肌肌力(优效)、术后6个月/12个月腘绳肌与股四头肌的比值(优效)、术后12个月膝关节前交叉韧带恢复指数(RSI)(优效)以及KOOS评分等。而安全性指标为不良事件等。结合非临床和临床试验结果,FDA认为该产品受益大于风险。
当前,我国对于同种异体移植物、组织工程人工韧带等产品还未建立相关的专门标准或指导原则,但随着新材料新产品不断涌现,审评机构和人员将紧密跟踪了解相关产品的国内外审批上市经验,不断更新已上市产品的不良事件、现有临床专家共识和指南等,以更好地评估产品的风险和受益,科学地引导申报企业充分论证产品的安全有效性。
(作者单位:国家药监局医疗器械技术审评长三角分中心)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






