- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
每周医药看点(1月15日至1月21日)
 |
|
《罕见病基因治疗产品临床试验技术指导原则》《人源干细胞产品非临床研究技术指导原则》《药物免疫毒性非临床研究技术指导原则》等文件发布,22个仿制药质量和疗效一致性评价任务公示……1月15日—21日,医药行业的这些动态值得关注。
行业政策动态
1 国家药监局药品审评中心(CDE)发布《重组腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则》《间充质干细胞防治移植物抗宿主病临床试验技术指导原则》《罕见病基因治疗产品临床试验技术指导原则》《人源干细胞产品非临床研究技术指导原则》《药物免疫毒性非临床研究技术指导原则》《放射性标记人体物质平衡研究技术指导原则》《抗肿瘤药物说明书安全性信息撰写技术指导原则》《治疗用重组蛋白产品临床试验申请病毒清除工艺平台验证技术指导原则(试行)》。
2 CDE就《化学仿制药参比制剂目录(第七十八批)(征求意见稿)》公开征求意见,涉及硫酸沙丁胺醇吸入粉雾剂等品种。征求意见时间为2024年1月18日—31日。
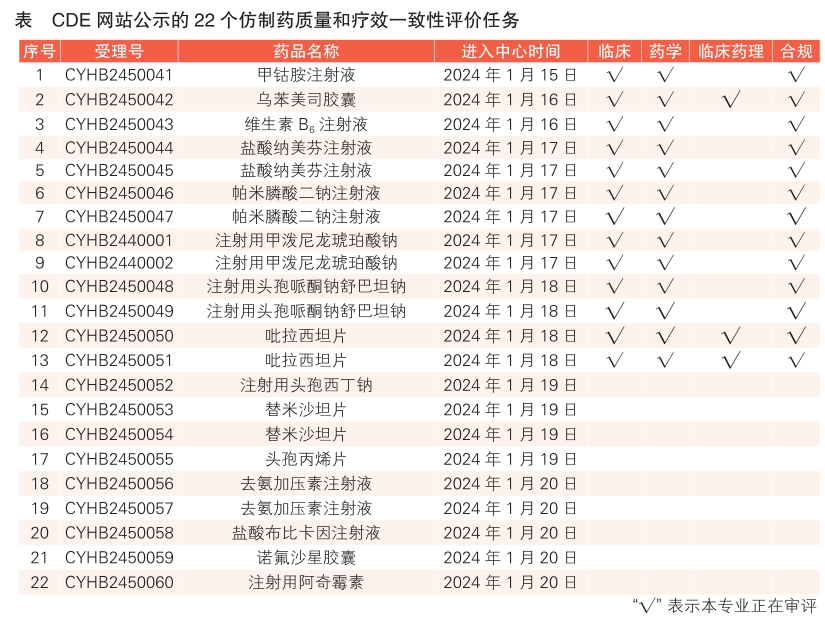
3 CDE网站公示22个仿制药质量和疗效一致性评价任务,涉及甲钴胺注射液等品种(详见表)。
产品研发上市信息
1 国家药监局批准惠升生物制药股份有限公司申报的1类创新药脯氨酸加格列净片上市。该药适用于单药治疗或与盐酸二甲双胍联合使用,改善成人2型糖尿病患者的血糖控制。
2 国家药监局发布3期药品批准证明文件送达信息,包括198个受理号,涉及惠升生物制药股份有限公司等企业。
3 CDE承办受理44个新药上市申请,包括注射用BL-M07D1等药品。
4 健友股份发布公告称,其子公司健进制药收到美国食品药品管理局(FDA)签发的奥沙利铂注射液50mg/10mL和100mg/20mL(5mg/mL)(单剂量)的简略新药申请(ANDA)批准通知。
5 永安药业发布公告称,其“一种牛磺酸母液回收利用的方法”收到美国专利商标局的发明专利证书。
6 齐鲁制药宣布,其雷珠单抗注射液生物类似药获得欧洲药品管理局(EMA)批准上市。公开资料显示,这是一种重组抗VEGF人源化单克隆抗体Fab注射液。
7 石药集团宣布,其开发的双特异性融合蛋白药物JMT106的临床试验申请已获美国FDA批准。
医药企业观察
1 君实生物宣布,特瑞普利单抗联合化疗用于可切除非小细胞肺癌(NSCLC)围手术期治疗的Ⅲ期NEOTORCH研究,在国际权威期刊《美国医学会杂志》(JAMA)上发表。这是特瑞普利单抗第二项登上JAMA主刊的Ⅲ期临床研究,该研究由上海交通大学医学院附属胸科医院陆舜教授牵头开展。
2 特科罗生物宣布获得万物创投数百万美元的Pre-B轮融资。特科罗生物成立于2014年,专注于皮肤病适应证未被满足的临床需求,自主研发创新药。
3 恒赛生物宣布,继2023年11月完成亿元级融资后,公司再次获得数千万元的A+轮融资,用于推进产品管线拓展、临床申报以及研发中心建设等。此次融资由翠亨集团、西湾投控、中山创投和成铭资本共同参与投资。
药品集中采购
1 山东省医疗保障局发布《关于做好部分药品集中采购中选结果下一年度采购工作的通知》,明确将开展部分药品集中采购中选结果续签工作。品种范围包括国家组织集采协议期满药品山东省接续采购(202112)38个品种、国家组织集采协议期满药品山东省接续采购(202212)43个品种、国家组织第四批药品集采3年采购周期12个品种、国家组织第五批药品集采3年采购周期35个品种、国家组织第七批药品集采60个品种、山东省第三批(中成药专项)集采品种。
2 湖南省医疗保障局发布《关于开展京津冀“3+N”联盟部分西药和中成药带量联动采购中选产品协议采购量确认工作的通知》。根据通知,申报企业可与采购主体双向选择,确定中选产品及协议采购量。申报企业结合采购需求量和自身供应能力,确认供应意向。对于申报企业确认的,选择成功;对于申报企业拒绝供应以及谈判不成功的产品,对应采购需求量作为待分配量,由采购主体重新分配给其他符合条件同品种名称的申报产品。如分配给既往轮次确认供应的申报产品,原则上企业不可拒绝;如分配给既往轮次未分配采购需求量的申报产品,申报企业继续确认供应意向,至采购主体将所有采购需求量完成双向选择。 (刘思慧整理)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






