- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
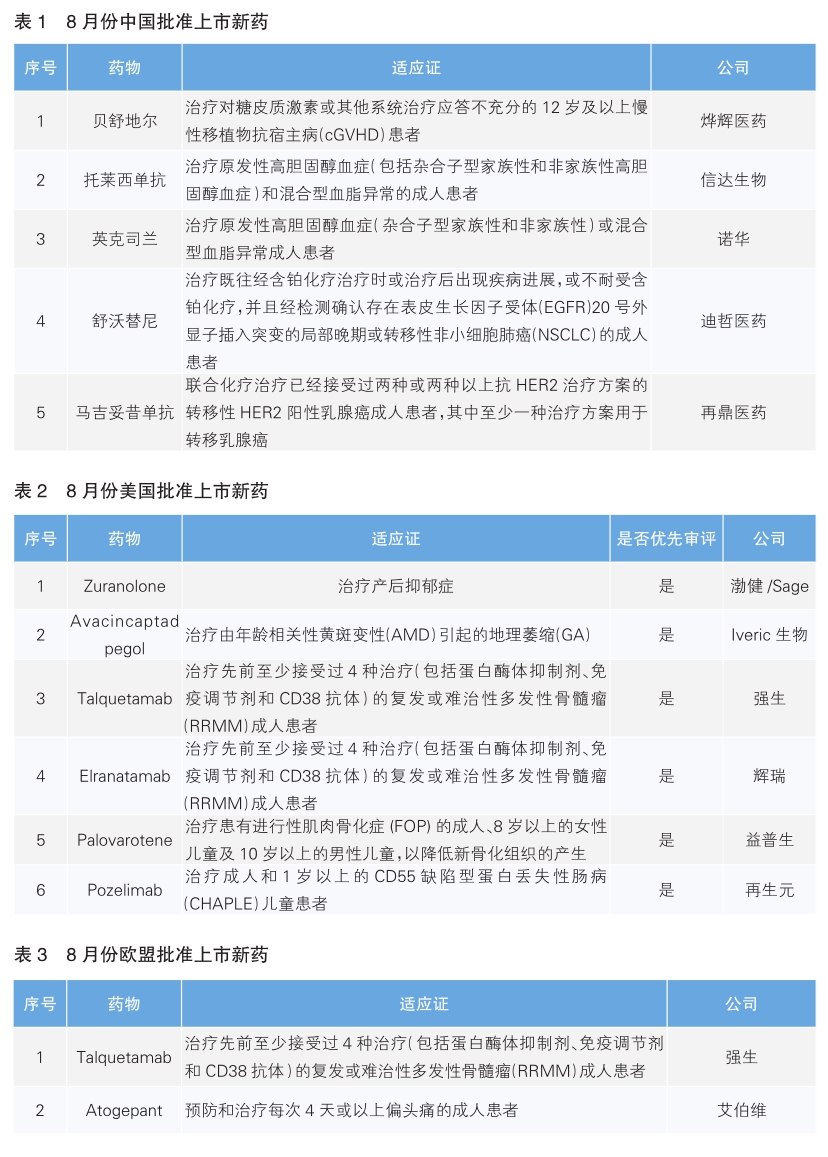
8月份中美欧批准上市新药盘点
全球首个进行性肌肉骨化症创新疗法获批
 |
|
□ 陈倩
8月份中美欧批准上市的新药中,合计有7款为全球首次获批的新药。其中,Palovarotene是全球首个也是唯一一个获批用于治疗罕见病进行性肌肉骨化症(FOP)的药物。
我国批准5款新药上市
8月份,我国批准了5款新药上市。根据Pharmadigger数据库,托莱西单抗和舒沃替尼是我国自主研发且为全球首次批准的新药。
贝舒地尔(Belumosudil)由Kadmon公司开发,2019年,烨辉医药与Kadmon Holdings达成战略合作,成立合资公司BK Pharmaceuticals,在中国开发和商业化该药物,用于治疗慢性移植物抗宿主病(cGVHD)。贝舒地尔是一种选择性Rho相关卷曲螺旋蛋白激酶2(ROCK2)抑制剂,通过抑制ROCK2介导的信号通路,能通过减轻STAT3的磷酸化,加强STAT5的磷酸化,从而下调过度活化的T辅助细胞(Th17),并增强调节性T细胞(Treg)功能,进而重建免疫平衡。该药最早于2021年7月在美国获批上市,用于治疗12岁以上的cGVHD患者。其在美国获批基于一项名为ROCKstar的临床试验,结果显示,贝舒地尔治疗组患者的总缓解率(ORR)为75%,完全缓解率为6%。
托莱西单抗是信达生物自主研发的一款创新IgG2全人源单克隆抗体,能特异性结合PCSK9分子,通过减少PCSK9介导的低密度脂蛋白受体(LDLR)内吞来增加LDLR水平,继而降低低密度脂蛋白胆固醇(LDL-C)水平。该药本次获批主要基于名为CREDIT-2、CREDIT-1和CREDIT-4的3项临床试验,结果显示与安慰剂相比,托莱西单抗可降低LDL-C水平约50%,且实现了长间隔给药(每6周1次)。托莱西单抗是国内首款本土企业原研的PCSK9单抗药物。
英克司兰是诺华研发的一款靶向PCSK9的小干扰核酸(siRNA)药物,每年进行两次注射即可降低LDL-C,是一款长效降脂siRNA药物。英克司兰可直接与编码PCSK9蛋白的mRNA结合,通过RNA干扰作用降低mRNA的水平,从而防止肝脏生成PCSK9蛋白。临床试验结果显示,对于使用最大耐受剂量的他汀类药物治疗后仍无法使LDL-C达标的患者,英克司兰能够降低其LDL-C至50%水平。英克司兰最早于2020年12月在欧盟获批上市。
舒沃替尼是迪哲医药自主研发的一款口服、不可逆抑制、针对多种EGFR突变亚型的高选择性EGFR酪氨酸激酶抑制剂(TKI)。该药此次获批主要基于一项名为WU-KONG6的单臂Ⅱ期临床试验。该试验针对含铂化疗出现进展或不耐受的EGFR exon20ins晚期非小细胞肺癌(NSCLC)患者,结果显示,在接受舒沃替尼治疗的97例NSCLC患者中,ORR约达60%,安全性与传统EGFR-TKI相似,整体耐受性好。
马吉妥昔单抗是MacroGenics公司开发的一种靶向HER2的Fc优化型单克隆抗体,能够降低HER2胞外域脱落和抗体介导的细胞毒杀伤效应(ADCC)。该药此次在我国上市是基于名为SOPHIA的全球Ⅲ期临床试验和桥接试验的积极数据。SOPHIA结果显示,马吉妥昔单抗与曲妥珠单抗进行头对头研究,显示可显著延长患者无进展生存期。2018年11月,再鼎医药与MacroGenics就马吉妥昔单抗和另外两款单抗达成战略合作协议,再鼎医药负责马吉妥昔单抗在大中华区的开发及商业化。
美国批准6款新药上市
8月份,美国批准6款新药上市。根据Pharmadigger数据库,均为全球首次获批新药。
Zuranolone(Zurzuvae)是渤健和Sage公司开发的新一代γ-氨基丁酸(GABAA)受体正向变构调节剂。大脑中的GABAA受体和NMDA(N-甲基-D-天冬氨酸)受体分别发挥抑制和刺激大脑神经元产生神经冲动的作用,这两种受体活性之间的失衡是包括抑郁症在内的多种精神疾病的原因。Zuranolone能够同时调节位于神经突触内和突触外的GABAA受体功能,恢复大脑内GABAA受体和NMDA受体活性之间的平衡,因此具有治疗包括抑郁症在内的精神疾病的潜力。该药本次获批主要是基于名为NEST的研发项目的积极数据,NEST研发项目包括Zuranolone针对成年女性产后抑郁患者进行的两项研究(ROBIN和SKYLARK研究)。在SKYLARK研究中,与安慰剂相比,在第15天,Zuranolone 50mg治疗组抑郁症状方面表现出具有统计学和临床意义的改善。
Avacincaptad pegol(Izervay)是Iveric生物研发的一种新型补体蛋白C5抑制剂,是一款与支化聚乙二醇(PEG)分子共价结合的RNA适配体,能与补体蛋白C5结合并对其产生抑制作用,以减缓地理萎缩(GA)的进展。该药此次获批是基于名为GATHER1与GATHER2的两项Ⅲ期临床试验。结果显示,与假性试验组相比,接受Avacincaptad pegol治疗患者的GA增长率在统计学上有显著降低,最早在6个月时就观察到了疾病进展的减慢,在治疗的第一年中GA增长率的下降高达35%。
Talquetamab(Talvey)是强生研发的一款G蛋白偶联受体C5家族亚型D(GPRC5D)/ CD3双特异性抗体,能够激活带有CD3受体的T细胞,并诱导其杀伤GPRC5D表达阳性的多发性骨髓瘤(MM)肿瘤细胞。该药本次获批是基于名为MonumenTAL-1的Ⅱ期临床试验,结果显示,当Talquetamab给药频率为每两周皮下注射0.8mg/kg时,约3/4的患者获得了客观缓解。
Elranatamab(Elrexfio)是辉瑞研发的一种人源化双特异性抗体,靶向BCMA和CD3,从而激活T细胞杀伤表达BCMA的癌细胞。该药此次获批是基于名为MagnetisMM-3的单臂临床试验,结果显示,97例患者的ORR为57.7%,其中有84%的患者在9个月时维持缓解。
Palovarotene(Sohonos)是一种可口服的选择性视黄酸受体γ(RARγ)激动剂,最初被罗氏开发用于治疗慢性阻塞性肺病(COPD),但治疗效果不佳。后来经研究发现可通过介导视黄素信号传导途径中的受体、生长因子和蛋白质之间的相互作用,从而起到抑制异位骨化的作用。进行性肌肉骨化症(FOP)是一种极其罕见的遗传疾病,俗称“珊瑚人症”或“石头人症”,患病率约为1.36/百万人。其特点是在人体正常骨骼系统之外形成新骨,随着疾病的发展,患者会像石头一样无法正常活动,严重缩短患者的预期寿命。Palovarotene是当前全球唯一一款获批上市的FOP治疗药物。Clementia公司从罗氏买入Palovarotene后,益普生通过收购Clementia最终获得了该药的开发权益。在一项名为MOVE的单臂Ⅲ期临床试验中,与未经治疗患者相比,Palovarotene组患者的异位骨化比率下降了62%。
Pozelimab(Veopoz)是再生元研发的一种靶向补体蛋白C5的全人源单克隆抗体,旨在阻断补体因子C5的活性,预防由补体途径介导的疾病。该药本次获批基于一项Ⅱ/Ⅲ期临床试验,结果显示,CD55缺陷型蛋白丢失性肠病(CHAPLE)患者在接受Pozelimab治疗后,在24周时,所有患者都达到了共同主要终点,患者的疾病生物标志物能持续地恢复正常,并且临床症状得到了改善或没有出现恶化。
欧盟批准2款新药上市
8月份,欧盟批准了2款新药上市,为Talquetamab和Atogepant,根据Pharmadigger数据库,均非全球首次批准。
Atogepant(Qulipta)是艾伯维研发的一种口服降钙素基因相关肽(CGRP)受体拮抗剂。该药本次获批基于两项Ⅲ期临床试验,结果显示,与安慰剂相比,在慢性和发作性偏头痛的成年患者中,Atogepant组患者在12周治疗期内平均每月出现偏头痛的天数具有统计学意义上的减少。此前Atogepant已于2021年9月在美国获批上市。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






