- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
2022年12月 2023年1月
中美欧批准上市新药盘点
我国两款本土自主研发的抗新冠病毒药物获批
 |
|
□ 陈倩
在2022年12月和2023年1月中美欧批准上市的新药中,中国批准上市的最值得关注的是两款本土自主研发的针对新冠病毒(COVID-19)感染的抗病毒药物,全球首次批准新药依然是美国最多。
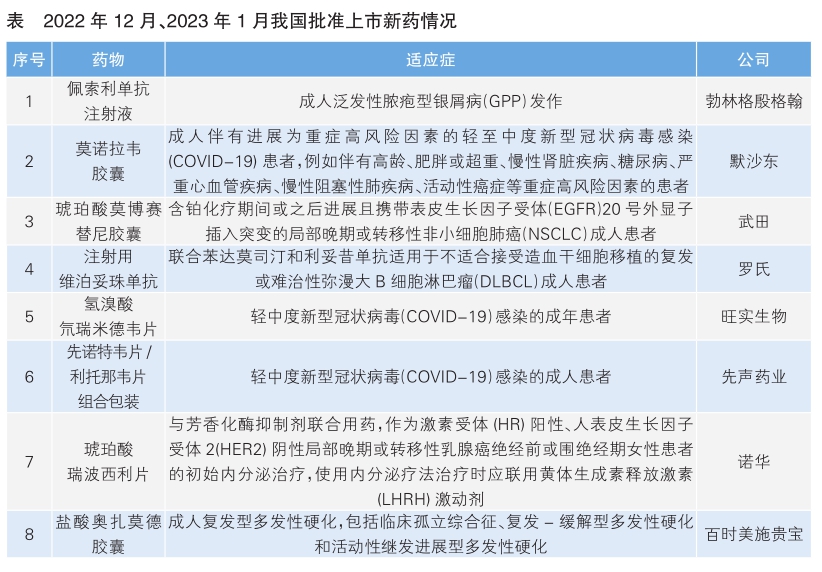
我国批准8款新药上市
2022年12月,我国批准了2款新药上市,其中默沙东的莫诺拉韦胶囊为应急附条件批准。
佩索利单抗是勃林格殷格翰公司研发的首个阻断白介素-36(IL-36)受体激活的单克隆抗体。IL-36是导致炎症循环、皮肤炎症、脓疱形成和异常组织重构的主要细胞因子。佩索利单抗通过与IL-36受体结合,阻断IL-36产生的炎症反应,从而抑制泛发性脓疱型银屑病(GPP)的炎症信号通路,实现脓疱和皮损的快速清除。本次获批是基于名为Effisayil1的Ⅱ期临床试验,结果显示,约一半的患者经该药治疗1周后便达到皮肤无可见脓疱。
2023年1月,我国批准了6款新药上市,其中氢溴酸氘瑞米德韦片和先诺特韦片/利托那韦片组合包装均为应急附条件批准的我国自主研发的治疗新冠病毒感染的新药。
氢溴酸氘瑞米德韦片是由中国科学院上海药物研究所、武汉病毒研究所和旺实生物共同开发的核苷类抗病毒药物,可抑制SARS-CoV-2病毒复制。2022年12月29日,旺实生物发布消息称,一项Ⅲ期临床试验结果显示,相比Paxlovid,氘瑞米德韦组的临床恢复时间更短。
先诺特韦片╱利托那韦片是由中国科学院上海药物研究所、武汉病毒研究所、先声药业共同开发的药物。先诺特韦针对SARS-CoV-2病毒复制必需的3CL蛋白酶,与低剂量利托那韦联用,有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。
琥珀酸莫博赛替尼胶囊是武田公司研发的针对EGFR20外显子插入突变的口服靶向药,EGFR外显子插入占所有EGFR突变的12%,这些患者的1年无进展生存(PFS)率仅为13%。该药的获批主要是基于其全球Ⅰ期、Ⅱ期临床试验以及EXCLAIM 延展队列研究,结果显示该品能改善铂类经治EGFR20外显子插入突变的晚期非小细胞肺癌(NSCLC)患者的生存获益,中位PFS达7.3个月。
维泊妥珠单抗是罗氏研发的全球首个靶向CD79b的抗体药物偶联物(ADC),此次维泊妥珠单抗用于初治难治性弥漫大B细胞淋巴瘤(DLBCL)患者适应症的获批是基于全球Ⅲ期临床试验POLARIX,结果显示,与化疗组(利妥昔单抗联合环磷酰胺、多柔比星、长春新碱和泼尼松)(R-CHOP)相比,维泊妥珠单抗联合R-CHP治疗组中受试者的2年PFS率取得具有统计学意义的显著性改善。
瑞波西利是诺华研发的在我国唯一获批的晚期一线绝经前适应症的CDK4/6抑制剂,本次获批基于名为MONALEESA-7的Ⅲ期临床试验,结果显示,对于绝经前/围绝经期乳腺癌患者,相比非甾体类芳香化酶抑制剂(NSAI)/他莫昔芬+戈舍瑞林组,瑞波西利联合NASI/他莫昔芬+戈舍瑞林可以显著降低患者死亡风险。
奥扎莫德是百时美施贵宝研发的选择性鞘氨醇1-磷酸(S1P)受体调节剂。多发性硬化是一种以中枢神经系统炎性脱髓鞘病变为主要特点的免疫介导性疾病,高发于青壮年。盐酸奥扎莫德胶囊此次获批基于名为SUNBEAM和RADI ANCE的两项Ⅲ期临床试验,结果显示,该药对比重组人干扰素β-1a可带来显著临床获益。
美国批准11款新药上市
2022年12月,美国批准7款新药上市。根据Pharmadigger数据库,Olutasidenib、Adagrasib、Lenacapavir、Mosunetuzumab、Ublituximab等5款药物为全球首次批准。
Olutasidenib是Rigel公司研发的靶向异柠檬酸脱氢酶1(mIDH1)突变的小分子抑制剂,结合并抑制mIDH1,能降低2-羟基戊二酸水平,恢复骨髓细胞的正常分化。此次获批是基于2102-HEM-101临床试验,结果显示,携带IDH1突变的复发难治急性髓系白血病成人患者在接受该药治疗后,约1/3能完全缓解(CR)加完全缓解伴部分血液学恢复(CRh),中位缓解持续时间为25.9个月。
Adagrasib是Mirati公司研发的具有高度特异性的强力口服KRAS G12C抑制剂,KRAS G12C突变约发生在14%的肺腺癌、4%的大肠癌和2%的胰腺癌中。本次获批基于名为KRYSTAL-1的Ⅱ期临床试验,结果显示,携带KRAS G12C突变的晚期NSCLC患者经该药治疗后,中位随访时间9个月时,客观缓解率为43%。
Lenacapavir是吉利德公司研发的首个长效艾滋病毒(HIV)衣壳抑制剂,旨在为对病毒治疗不再有有效应答的多重耐药HI V患者的长效治疗提供新的选择。本次获批基于名为CAPELLA的Ⅱ/Ⅲ期临床试验,接受该药治疗的患者在服药14天后对比接受安慰剂治疗的患者获得了病毒减少(88%vs.17%)的效果。
Mosunetuzumab是罗氏研发的靶向B细胞表面的CD20抗原和T细胞表面的CD3受体的T细胞衔接双特异性抗体。本次获批基于Ⅱ期GO29781临床试验的结果,在先前接受过2次或2次以上治疗的复发或难治性滤泡性淋巴瘤患者中,该药诱导了持续至少18个月的持久完全缓解,有2/3患者能达到完全缓解。
Ublituximab是TG Therapeutics公司研发的CD20单抗药物,靶向B细胞表达的CD20抗原上的独特抗原表位。本次获批基于ULTIMATEⅠ、Ⅱ两项Ⅲ期临床试验数据,结果显示,试验超过96周时,与活性对照组Teriflunomide相比,Ublituximab组的复发型多发性硬化(RMS)患者的年复发率显著降低。
2023年1月,美国批准上市4款新药。根据Pharmadigger数据库,均为全球首次批准。
Lecanemab是卫材公司研发的抗β淀粉样蛋白(Aβ)单克隆抗体。该药获批基于Ⅱb期概念验证性临床试验,结果显示,对存在轻度认知障碍(MCI)并经证实存在淀粉样蛋白病变的阿尔兹海默症(AD)患者治疗18个月后,该药使脑淀粉样蛋白减少0.306SUVr单位(基线平均值为1.37),并且淀粉样蛋白减少的程度与ADCOMS(AD综合评分)、CDR-SB(临床痴呆症评分总和)和ADAS-cog(AD认知分量表)的临床下降更慢相关。
Bexagliflozin是Theracos公司研发的钠-葡萄糖协同转运蛋白2抑制剂(SGLT2i),是全球获批上市的第11款SGLT2i。本次获批是基于募集超过5000名2型糖尿病患者、包含23项临床试验的数据。结果显示,无论是以单剂、与二甲双胍联用或作为标准疗法的附加治疗,患者在使用该药24周后,其糖化血红蛋白(HbA1c)与空腹血糖水平皆显著下降。
Pirtobrutinib是礼来子公司Loxo Oncology研发的首个且唯一一款获批的非共价(可逆)BTK抑制剂,用于治疗既往接受过至少二线系统治疗(包括一种BTK抑制剂)的复发或难治性套细胞淋巴瘤(MCL)患者。该药不与C481产生共价结合,因此不会受到耐药C481突变对活性造成的抑制,有望克服共价BTK抑制剂的耐药性。本次获批基于BRUIN研究的结果,经该药治疗的MCL患者中有一半能获得客观缓解。
Elacestrant是Radius Health研发的全球首款口服选择性雌激素受体降解剂,用于治疗既往至少接受一种内分泌治疗后疾病仍有进展的雌激素受体(ER)阳性、HER2阴性、ESR1突变的晚期或转移性乳腺癌的绝经后女性或成年男性。本次获批基于名为EMERALD的Ⅲ期临床试验,结果显示,与内分泌治疗相比,接受该药治疗的患者疾病进展或死亡风险降低了45%。
欧盟批准7款新药上市
2022年12月,欧盟批准了7款新药上市。其中Tabelecleucel为全球首次批准的新药。
Tabelecleucel是皮尔法伯公司研发的全球首个获批的同种异体T细胞免疫疗法,以人类白细胞抗原(HLA)限定的方式靶向并消除EBV感染的细胞。EBV+PTLD是一种罕见的、急性的、潜在致命的血液系统恶性肿瘤,发生在患者移植后T细胞免疫反应受到免疫抑制损害时,包括接受实体器官移植(SOT)或同种异体造血细胞移植(HCT)的患者。此次获批基于关键的Ⅲ期ALLELE临床研究的结果,在43例可评估患者(29例SOT后,14例HCT后)中,有一半的患者病情有所缓解。
2023年1月欧盟无批准上市的新药。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






