- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
完善产品设计 重视临床证据
——浅谈基于NGS技术的NSCLC基因变异检测试剂审评现状及关注点
 |
|
□ 方丽
高通量测序技术即下一代测序(NGS)技术,目前广泛应用于肿瘤诊疗领域,用于检测肿瘤组织中的基因变异。肿瘤基因变异类型包括点突变、插入、缺失、重排/融合、拷贝数异常等。伴随着精准医疗的蓬勃发展,NGS技术在抗肿瘤药物伴随诊断领域也起到了重要作用。
肺癌是我国目前发病率和死亡率最高的恶性肿瘤。按照病理学分类,肺癌可分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)两种类型,其中NSCLC是最为常见的组织学类型。随着分子生物学技术的发展,人们对于NSCLC的认识已经从组织水平发展到分子水平。越来越多的肿瘤相关基因变异类型被发现,基于基因变异的靶向治疗方式在NSCLC治疗领域发挥着良好的临床效果。
近年来,基于NGS技术的肿瘤基因变异检测试剂申报数量逐渐增多,尤其以针对NSCLC的产品居多。与常规基于PCR技术的检测产品不同,此类产品相对比较复杂,所涵盖的基因及变异类型较多,同时技术原理、产品设计均具有特殊性。因此,有必要针对其产品设计、临床试验方法、临床证据提交等进行研究。
国内相关产品注册情况
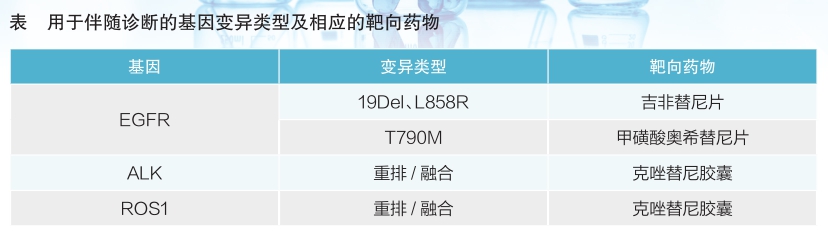
2018年,广州燃石医学检验所有限公司的人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)、天津诺禾致源生物信息科技有限公司的人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突变检测试剂盒(半导体测序法)、厦门艾德生物医药科技股份有限公司的人类10基因突变联合检测试剂盒(可逆末端终止测序法)、南京世和医疗器械有限公司的EGFR/ALK/ROS1/BRAF/KRAS/ HER2基因突变检测试剂盒(可逆末端终止测序法)等作为第一批基于NGS技术的用于NSCLL的基因变异检测试剂进入创新产品通道而获批上市。截至目前,已有10余个该类产品获批,且还有许多相关产品正在申报过程中。
从已获批产品以及尚在申报过程中的产品来看,其所采用的NGS技术主要基于三大技术平台:可逆末端终止测序法、半导体测序法和联合探针锚定聚合测序法。上述已获批产品的说明书中均明确了用于伴随诊断的基因变异类型及相应的靶向药物(详见表),以及仅经过检测性能评价的基因变异类型。
产品审评关注点
在基于NGS技术的NSCLC基因变异检测试剂审评过程中,应重点关注产品设计和临床证据。
产品设计
随着NGS技术逐渐应用于临床,越来越多的基因及变异类型被检测发现,但这些个体的基因变异的临床意义尚未被充分证实。尽管通过NGS技术可以实现对几十个甚至几百个基因的变异情况进行检测,但作为体外诊断产品,并不是涵盖的基因及变异类型越多越好。
申请人应综合考虑产品的风险受益以及患者的经济负担等多方面因素,保证产品所涵盖的基因及变异类型均应为经过充分的临床验证而确定的。
在进行产品设计时,申请人应以NSCLC相关临床诊疗指南等行业公认的指导性文件作为参考,将用于指导抗肿瘤药物使用的伴随诊断基因位点作为一级位点;而其他已被写入诊疗指南但并不具有明确的伴随诊断临床意义的基因及位点,则可作为二级位点。
根据美国国家综合癌症网络(NCCN)发布的《NCCN非小细胞肺癌临床诊治指南》,对NSCLC进行分子标志物检测非常重要,这不仅能够识别出可能有效的治疗靶点,并且有助于避免无效治疗。
该指南建议,对NSCLC患者应进行至少8种与NSCLC个性化治疗方案高度相关的驱动基因检测,以确定最佳的治疗方案。这8种基因分别为EGFR(第19号外显子缺失,第21号外显子L858R点突变,第19号外显子插入及L861Q、G719X、S768I点突变,第20号外显子T790M突变,第20号外显子插入) 、ALK(重排/融合)、ROS1(重排/融合)、BRAF(V600E)、KRAS点突变(第12号密码子点突变)、MET(第14号外显子跳跃突变)、RET(重排)、NTRK(融合)。
由中华医学会病理学分会、国家病理质控中心等单位在《中华病理学杂志》发表的《非小细胞肺癌分子病理检测临床实践指南(2021版)》指出,推荐作为必检基因的有:EGFR(第18~21号外显子点突变、缺失、插入)、ALK(重排/融合)、ROS1(重排/融合)、MET(第14号外显子跳跃突变);扩展检测基因或指标包括:MET(扩增)、HER2(第20号外显子插入突变)、BRAF(V600E)、RET(重排/融合)、KRAS(第2、3号外显子点突变)、NTRK(重排/融合)、肿瘤突变负荷(突变、缺失、插入等)。
中国临床肿瘤学会非小细胞肺癌专家委员会发布的《非小细胞肺癌诊疗指南2020》明确指出,考虑到我国NSCLC患者特有的基因变异频率、药物在我国的获批适应症以及药物可及性等因素,针对不可进行手术的晚期NSCLC患者推荐的首次分子标志物检测内容必须包含EGFR、ALK、ROS1这3个基因。
此外,中国临床肿瘤学会非小细胞肺癌专家委员会在发表于《中国肺癌杂志》的《二代测序技术在NSCLC中的临床应用中国专家共识(2020版)》中,明确推荐使用国家药监局批准的检测产品,无论是使用PCR、FISH还是NGS方法,建议同时检测EGFR突变、ALK融合和ROS1融合这3种形式的基因变异。
需要提醒申请人的是,产品如作为非原研伴随诊断试剂,在基因位点覆盖上应尽量与原研伴随诊断试剂保持一致。
临床证据
在临床性能评价方面,申请人应通过将申报产品与已上市的同类产品或核酸测序等参考方法进行比较研究,以评估其临床检测性能。在此部分临床试验中,应对申报产品所能检测的基因及变异类型进行充分评价。
对于临床上发生频率较低的基因变异,若在临床试验中无法纳入足够的阳性病例,在审评过程中应综合考虑该变异的类型、所在位置、与该变异共用引物探针的其他变异是否已被验证充分等,来对该基因变异类型的临床性能进行评价。
在临床意义证据方面,对于有明确伴随诊断临床意义的基因变异,应明确其所伴随的抗肿瘤药物,并提供相应的伴随证据。例如,对于与抗肿瘤药物共同开发的伴随诊断试剂,申请人可提供支持该药物上市的关键性药物临床试验数据作为该试剂的伴随诊断证据。
若申报产品为在抗肿瘤药物上市后所开发的非原研伴随诊断试剂,申请人可通过将其与原研伴随诊断试剂进行一致性比对或开展桥接试验、回顾性药物疗效观察性研究等,提供其伴随诊断证据。同时,申请人可根据伴随诊断试剂相应的指导原则提交临床证据。
此外,对于二级位点,如境内尚无同类产品获批上市,申请人应提供相关诊疗指南等行业公认的支持性资料作为其具有临床意义的证据。
(作者单位:国家药监局医疗器械技术审评中心)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






