- 国家市场监督管理总局
- 国家药品监督管理局
- 中国健康传媒集团主办
- 中央新闻网站
以患者为中心 准确制定目标产品特性
——基于临床需求的药品研发和评价分析
 |
|
□ 李娅杰
药品审评审批制度改革的宗旨是鼓励以临床价值为导向的药物研发及创新。自2015年药品审评审批制度改革实施以来,我国药品监管政策环境发生了巨大变化。随着《疫苗管理法》和新修订《药品管理法》(以下简称新法)正式实施,药品监管领域各项配套法规制度陆续出台,为药品研发创造了良好的政策环境。与此同时,药品研发工作也顺应政策导向,逐渐回归研发本质——以患者为中心,服务临床需求。
鼓励基于临床需求进行药品研发及审评审批的政策导向
2015年8月,国务院印发的《关于改革药品医疗器械审评审批制度的意见》首次明确指出,“鼓励以临床价值为导向的药物创新”“对临床急需的创新药加快审评”。2017年10月,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,进一步明确“对治疗严重危及生命且尚无有效治疗手段疾病以及公共卫生方面等急需的药品医疗器械,临床试验早期、中期指标显示疗效并可预测其临床价值的,可附带条件批准上市”。
上述两份意见确立了“鼓励基于临床需求进行药品研发和审评审批”的政策导向。新法对该政策导向赋予了法律效力。新法第十六条规定,国家支持以临床价值为导向、对人的疾病具有明确或者特殊疗效的药物创新;第二十六条规定,对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可以附条件批准。2020年7月1日起正式实施的新修订《药品注册管理办法》,对新法相关规定作进一步细化,从部门规章角度赋予其执行效力。该办法第十三条规定,国家药品监督管理局建立药品加快上市注册制度,支持以临床价值为导向的药物创新。对符合条件的药品注册申请,申请人可以申请适用突破性治疗药物、附条件批准、优先审评审批及特别审批程序。在药品研制和注册过程中,药品监督管理部门及其专业技术机构给予必要的技术指导、沟通交流、优先配置资源、缩短审评时限等政策和技术支持。
提供加快上市路径,促进基于临床需求的药品研发
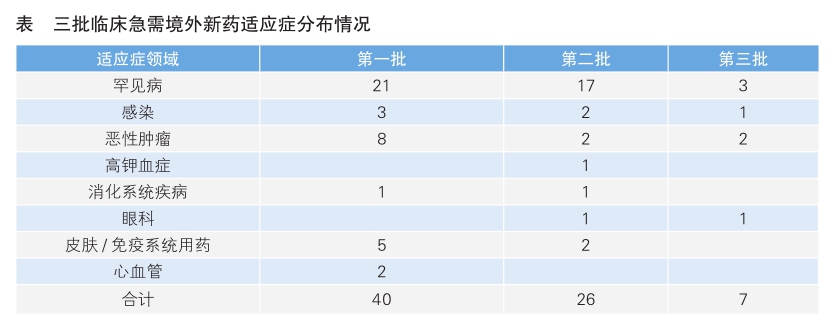
2018年10月,国家药监局、国家卫健委联合发布《临床急需境外新药审评审批工作程序》,该程序对近10年在欧美日上市但未在我国境内上市的三种新药设立专门通道,加速审评审批,包含用于治疗罕见病的药品;用于防治严重危及生命且尚无有效治疗或预防手段的疾病的药品;用于防治严重危及生命疾病且具有明显临床优势的药品。
截至2020年底,国家药监局药审中心(CDE)已公布三批临床急需境外新药名单,共包括73个药物(见表)。
2020年7月,国家药监局发布《突破性治疗药物审评工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》和《药品上市许可优先审评审批工作程序(试行)》,鼓励“真正满足临床需求”的好药尽快获批上市。
突破性治疗药物程序 用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。这对于申请人来说获益之处在于,CDE优先配置资源加强指导并促进药物研发。截至2020年12月31日,共26个产品被纳入突破性治疗药物程序。
附条件批准程序 附条件批准程序适用于现有临床研究资料尚未满足常规上市注册的全部要求,但药物临床试验已有数据显示该药物疗效并能预测其临床价值。因临床急需,在规定申请人必须履行特定条件的情况下基于替代终点、中间临床终点或早期临床试验数据附条件批准药品上市。附条件批准程序的适用范围包括,目标适应症为严重且危及生命的疾病;公共卫生方面急需的药品;应对重大突发公共卫生事件急需的疫苗或国家卫生行政部门认定急需的其他疫苗。
目前,我国已有多个品种适用附条件批准程序获批上市,如普乐沙福注射液、泽布替尼胶囊等。2020年11月,国家药监局发布《药品附条件批准上市技术指导原则(试行)》,进一步明确了附条件批准的技术要求及所附条件等。
优先审评审批程序 药品上市许可申请时,具有明显临床价值的药品可以申请适用优先审评审批程序。如临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;符合儿童生理特征的儿童用药品新品种、剂型和规格;疾病预防、控制急需的疫苗和创新疫苗;纳入突破性治疗药物程序的药品;符合附条件批准的药品;其他情形。
《2019年度药品审评报告》显示,在已纳入2019年优先审评的注册申请中,具有明显临床价值的新药占比最大,为34%。截至2021年1月11日,纳入优先审评审批程序的品种共有1219个。
除上述三种加速审批程序外,2005年原国家食药监局发布了《国家食品药品监督管理局药品特别审批程序》。该程序明确,当存在中华人民共和国主席宣布进入紧急状态或者国务院决定省、自治区、直辖市的范围内部分地区进入紧急状态;突发公共卫生事件应急处理程序依法启动等情形时,国家药品监管部门可以依法决定按照药品特别程序对突发公共卫生事件应急所需防治药品实行特别审批。
这四种路径申请的阶段、条件、侧重点各不相同,申请人可根据自身产品特点制定申请策略。对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可提出附条件批准申请和优先审评审批申请;对提出附条件批准上市申请的,也可一并提出优先审评审批申请。
加大临床需求在改良型新药及境外已上市新药审评中的权重
《化学药品注册分类及申报资料要求》提出,基于临床需求,合理开发改良型新药。对于2类境内外均未上市的改良型新药和5.1类境外上市的改良型药品申请在境内上市的,改良型药品应具有明显临床优势。CDE发布的《化学药品改良型新药临床试验技术指导原则》指出,临床优势即患者未被满足的临床需求,可体现为提高疗效,改善安全性和增加依从性等。在药品研发时,需立足明确的临床需求,在临床试验中对临床优势进行确证。
境外已上市药品境内上市或仿制,是解决我国患者对临床急需药品需求的重要手段。2020年10月发布的《境外已上市境内未上市药品临床技术要求》基于我国患者的临床需求提出了不同的技术要求。该技术要求指出,该类产品在境内上市需开展的临床试验技术要求需在充分评价我国患者临床需求,境外原研药品临床安全性和有效性,以及种族因素影响的基础上,基于我国患者获益/风险评估的需要进行确定。对用于临床缺乏有效治疗手段的危重疾病和罕见病治疗的药品等,监管机构持鼓励态度,以解决公众用药可获得性为首要前提进行审评审批。同时,鼓励境外原研药品自临床早期研发阶段即在中国同步开展临床试验。对于全球数据中已有中国人群药代(PK)和/或药效(PD)、有效性和安全性数据,经分析认为其用于中国患者的获益大于风险的,相关境内外临床试验数据可直接用于支持药品上市申请。对于全球数据中没有中国人群相关数据,但有较充分的种族因素相关研究和分析数据且未见明显种族因素影响的药品,可考虑附条件批准上市。对于较现有治疗手段未见明显临床优势的药品,应基于其数据情况在中国患者中进行必要的临床试验。
新药开发应树立以临床需求为导向、以患者为核心的理念
近年来,我国创新药物研发数量逐年递增,改良型新药和境外已上市产品的仿制更注重临床价值,国内生物医药市场总体规模不断扩大,生物医药企业数量持续增加。同时,全国各地纷纷建立生物医药园区,在环渤海、长三角、珠三角和中西部地区形成多个生物医药产业集群,药品研发形成你追我赶之势。
如何使自家产品在激烈的市场竞争中脱颖而出成为药企的工作重心之一。笔者认为,在产品研发阶段,企业需为每个产品确定目标产品特性(TPP),树立以终为始思维,通过不断优化调整TPP来实现产品的价值最大化。
药品上市的基础是具有临床价值。在药品研发阶段需要以临床需求为导向,通过深入了解疾病的流行病学特征、严重程度和预后、疾病的治疗现状及其局限性、临床治疗趋势及未来竞争格局等,针对产品自身差异化特点,建立以患者为中心的研发思路与整体计划,合理进行药学、临床前和临床研究,从而在产品上市时更好地体现产品特色。高效定义并不断优化调整TPP是科学研发思路的集中体现。企业需要在此过程中不断考虑产品的适应症定位、靶向人群、治疗顺序、给药方案、差异化特点、医生处方驱动因素以及定价策略等,其核心即建立以临床需求为导向、以患者为核心的研发理念。(作者单位:精鼎医药)
©2019中国食品药品网京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有






