国家药监局发布《仿制药参比制剂目录(第九十批)》;国家药监局药品审评中心(CDE)发布《晚期胃癌新药临床试验设计指导原则》……2月10日—16日,医药行业这些动态值得关注。
行业政策及药监动态
1 国家药监局发布《仿制药参比制剂目录(第九十批)》,该目录由国家药监局仿制药质量和疗效一致性评价专家委员会审核确定。
2 国家中医药局综合司、国家药监局综合司发布《古代经典名方关键信息表(“旋覆代赭汤”等43首方剂)》,以加快推动古代经典名方中药复方制剂上市,更好发挥中医药特色优势,满足人民群众用药需求。
3 CDE发布《晚期胃癌新药临床试验设计指导原则》,该指导原则是针对胃癌具有高度的异质性和治疗呈现出多样化的特点,为应对临床试验设计和终点选择带来的挑战而制定。
4 国家医保局办公室印发《医保领域“高效办成一件事”2025年度第一批重点事项清单》,本次清单涉及定点医药机构、医药企业、参保人员三个主体,共列出六个主要事项,包括医药企业集采医用耗材、国谈药直接结算等。
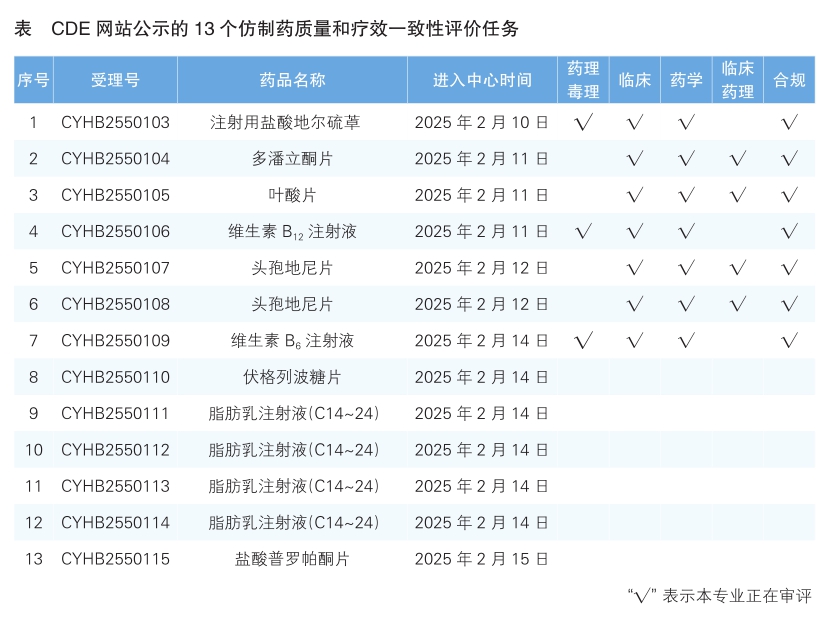
5 CDE网站公示13个仿制药一致性评价任务(详见表),涉及多潘立酮片等品种。
产品研发上市信息
1 国家药监局发布5期药品批准证明文件送达信息,共包括175个受理号,涉及赛诺菲(中国)投资有限公司等企业。
2 CDE承办受理43个新药上市申请,包括人脐带间充质干细胞注射液等。
3 石药集团发布公告称,公司开发的SYH2059片已获得美国食品药品管理局(FDA)批准,可以在美国开展临床试验。SYH2059片是一款具有完全自主知识产权的高活性与高选择性的环核苷酸磷酸二酯酶4B(PDE4B)抑制剂,适应证为间质性肺疾病。
4 达歌生物宣布,公司分子胶降解剂DEG6498的美国新药临床试验申请已获得FDA批准,公司即将启动该药物在结直肠癌、肺癌、肝癌和其他类型实体肿瘤患者中的全球临床开发。DEG6498是针对HuR靶点开发的分子胶药物,也是该公司在研管线中第一款进入临床开发阶段的药物。
5 复星医药发布公告称,公司控股子公司上海复宏汉霖生物技术股份有限公司及其控股子公司(以下合称复宏汉霖)收到FDA关于同意HLX99开展临床试验的批准,复宏汉霖拟于条件具备后在美国开展HLX99的Ⅰ期临床试验。HLX99为复星医药自主研发的创新型小分子偶联化学药物,拟用于治疗肌萎缩侧索硬化(ALS)。
医药企业观察
1 纳美信生物宣布,公司完成A轮融资,本轮融资由成都生物城国生资本和恩然创投共同投资,融资资金将主要用于推进NR222项目的临床研究以及新项目的研发。本轮融资的落地是投资方对公司的认可,也为公司推动后续临床研究注入强劲动力。
2 艾捷博雅宣布,公司完成亿元级别新一轮融资,本轮融资由华大共赢基金及德同资本投资,部分老股东持续追投,生命资本担任本轮融资财务顾问。本轮融资将继续用于公司产业链布局,加速推进公司完善药物分离纯化解决方案及临床质谱前处理自动化方案平台的搭建。
3 百洋医药发布公告称,公司与上海罗氏制药有限公司签订商业化合作协议。根据协议条款,百洋医药将获得罗氏制药旗下经典肿瘤靶向药美罗华(英文商品名:MabThera,通用名:利妥昔单抗)在中国的独家市场推广权。该药物主要用于治疗非霍奇金淋巴瘤、慢性淋巴细胞白血病等疾病。本次合作将进一步推进经典肿瘤药物在中国的可及性,百洋医药将基于覆盖全生命周期的品牌运营能力,持续推动该药物释放品牌价值。
4 百利天恒宣布,公司与三生制药达成战略合作,双方将共同推进BL-B01D1和707联合用药。
药品集中采购
1 全国中成药联合采购办公室公布全国中成药采购联盟集中采购中选结果的通知,共有174个药品中选。
2 江苏省医保局药品医用耗材阳光采购服务网发布了2025年第三批药品价格预警,涉及四川同人泰药业的健脾益肾颗粒、广东松下药业的香砂六君丸等12个药品。
(本报实习记者张一整理)