□ 况宇迪 郝丽静
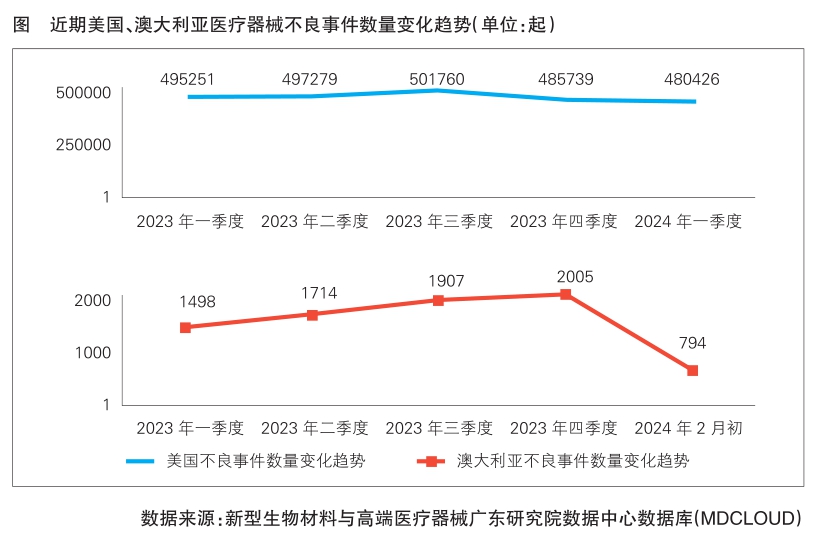
医疗器械不良事件是指已上市的医疗器械,在正常使用情况下发生的、导致或者可能导致人体伤害的各种有害事件。不良事件数据是医疗器械上市后监管重要数据源之一。据新型生物材料与高端医疗器械广东研究院数据中心(以下简称高端医械院数据中心)统计,2024年一季度美国披露的医疗器械不良事件数共480426起,较2023年同期均有所下降;澳大利亚2024年一季度医疗器械不良事件数据暂未完全披露,从2023年各季度数据来看,澳大利亚不良事件数呈逐渐上升趋势。以下对美国和澳大利亚近期不良事件数据进行回顾与分析(澳大利亚不良事件数据披露最新时间为2024年2月初,取2023年11月至2024年1月数据进行统计分析)。
整体情况
美国
据高端医械院数据中心统计,2024年一季度美国医疗器械不良事件数据库共披露480426起不良事件,对比2023年一季度的495251起,减少了14825起,同比下降2.99%。1月份和3月份不良事件数同比均呈下降趋势,3月份下降幅度较大,同比下降7.38%。
美国医疗器械不良事件数据库将不良事件的事件类型界定为:故障、致伤、致死、无解释和其他,另有少量事件没有划分。据高端医械院数据中心统计,2024年一季度美国不良事件占比最高的事件类型为故障事件,达67.28%,共发生323245起;其次为致伤事件,共有154180起,占总数的32.09%;致死事件共发生了2708起,占0.56%。此外,还有293起不良事件为未解释及其他事件类型。对比2023年一季度,2024年一季度美国不良事件的致伤事件类型比例上升了3.10%,故障事件类型下降了3.21%,致死事件类型比例相对稳定。
从2024年一季度披露的不良事件报告来源来看,共有468056起不良事件报告来源于制造商,占比高达97.43%;另有8019起报告来源于分销商,3513起为自愿上报,838起来自使用单位,占比分别为1.67%、0.73%、0.17%。与2023年一季度相比,各报告来源占比相对稳定。
澳大利亚
据高端医械院数据中心统计,2023年11月至2024年1月澳大利亚共披露医疗器械不良事件2090起,较上年同期(2022年11月—2023年1月)1600件增长30.63%。其中,2024年1月份不良事件数增长幅度最大,为760件,相比2023年1月份的479件增加了281件,同比增长58.66%。
澳大利亚对不良事件引发后果分为:致伤、致死和未致伤三类。据高端医械院数据中心统计,2023年11月至2024年1月共有1332起不良事件致伤,占总事件数的63.73%,占比较上年同期上升了0.92%;610起未致伤,占总事件数的29.19%;25起致死,占总事件数的1.20%。值得注意的是,2023年1月至2024年1月致伤不良事件数量随月份呈波动上升趋势,2024年1月份致伤事件数达峰值——503起,也是近5年来单月致伤事件数峰值。
从不良事件报告来源类型看,2023年11月至2024年1月澳大利亚的不良事件上报主要来自医疗器械行业的制造商和供应商,上报数量为1942起,占92.92%;59起来自其他报告人,占2.82%;57起来自医疗专业人士,占2.73%;24起来自消费者,占1.15%;8起来自医学研究员,占0.38%。与上年同期(2022年11月—2023年1月)相比,2023年11月至2024年1月制造商和供应商、医学研究员上报比例有所提升,消费者和医疗专业人士上报比例有所下降,整体以制造商和供应商上报为主。
产品分析
美国
通过统计美国产品分类代码对应的2024年一季度不良事件数,不良事件数量最多的单类产品为工厂校准式一体型连续血糖监控系统,共报告了75296起;其次为根管重塑牙内-骨内种植体和备用控制器启用的胰岛素输注泵。在不良事件数量前十位的产品中,共有四类产品为胰岛素泵相关产品,共计报告了89737起;有两类产品为血糖监测产品,共有82447起。值得注意的是,2024年一季度完全植入式止痛用脊髓刺激器不良事件数增长幅度较大,同比增长86.79%。
从美国各产品分类不良事件数量增量来看,2024年一季度较上年同期不良事件数量增长最多的是备用控制器启用的胰岛素输注泵,增加了12678起。其次为工厂校准式一体型连续血糖监控系统,增加了6855起。不良事件数TOP3产品分类的高频设备问题如下。
对工厂校准式一体型连续血糖监控系统的不良事件涉及的设备问题进行数量统计显示,排在前五位的高频设备问题分别为:“无线通信问题”“结果或读数不正确、不充分或不精确”“无设备输出”“意外的应用程序关闭”“过早报废指示器”。提示该类产品的不良事件主要与设备的通信故障、信号输出、指示器寿命短、结果不精确等问题相关。
对根管重塑牙内-骨内种植体的不良事件涉及的设备问题进行数量统计显示,排在前五位的高频设备问题分别为:“骨整合失败”“骨整合丧失”“没有识别设备或使用问题的不良事件”“植入物破损或物理损伤”“断裂”。提示该类产品的不良事件主要与种植体骨整合失败或是与骨组织连接出现问题相关。
对备用控制器启用的胰岛素输注泵的不良事件涉及的设备问题进行数量统计显示,排在前五的高频设备问题分别为:“泵送停止”“电池问题”“充电问题”“不正确的测量”“通讯或传输问题”。提示该类产品的不良事件主要与产品的泵送故障、电池问题、测量不准等问题相关。
对这三类产品的不良事件涉及的患者问题进行数量统计,可以看到三者最高频的患者问题均为“没有临床体征、症状或状况”,尤其是血糖监控系统与备用控制器启用的胰岛素输注泵,说明这两类产品的不良事件大多数并未对患者造成伤害。种植体由于骨整合出现问题后,会导致种植体周围纤维化,乃至植入失败,造成患者出现疼痛等临床反应。
澳大利亚
澳大利亚将器械产品分为:医疗器械(I类,Im类,Is类,Ⅱa类,Ⅱb类,Ⅲ类)、体外诊断器械(1类,2类,3类,4类)和有源植入器械三类。据高端医械院数据中心统计,2023年11月至2024年1月澳大利亚的医疗器械不良事件有1766起,占比91.93%;有源植入器械不良事件共114起,占比5.93%;体外诊断器械不良事件共41起,占比2.13%。与上年同期(2022年11月—2023年1月)相比,2023年11月至2024年1月医疗器械不良事件数增加了512件,占比上升了6.80%;体外诊断器械和有源植入器械的不良事件数量占比分别下降了2.69%和4.11%。
对三类器械的细分管理类别对应的不良事件数进行统计显示,Ⅲ类医疗器械不良事件最多,为913起,其次是Ⅱb类医疗器械539起。与上年同期(2022年11月—2023年1月)相比,2023年11月至2024年1月Ⅲ类医疗器械不良事件增量也最多,增加了391起,同比增长74.90%;Ⅱa类医疗器械、有源植入器械和3类体外诊断器械均有所下降。
2023年11月至2024年1月,澳大利亚不良事件数排前三的产品类别分别为动态胰岛素输注给药装置/遥控系统(145起)、心脏内植入式起搏器导线(91起)、皮下葡萄糖传感器(80起)。值得注意的是,与上年同期(2022年11月—2023年1月)相比,2023年11月至2024年1月,动态胰岛素输注给药装置/遥控系统、皮下葡萄糖传感器、植入式双腔自动除颤器、膝盖内置假体插入组件和频率反应式双腔起搏器不良事件数增幅明显,其中,膝盖内置假体插入组件和频率反应式双腔起搏器,同比增速分别为136.7%、162.5%。此外,血管造影用固定型X射线透视数字诊断系统不良事件数由去年同期的0起增至69起。
针对不良事件数最多的动态胰岛素输注给药装置/遥控系统,对其不良事件中的故障类型进行统计,可以看到高频的故障主要为:“机械”“材料完整性问题”“输注或流量问题”“无适当的名称/代码”。
(作者单位:新型生物材料与高端医疗器械广东研究院)