近日,国家药监局药品审评中心(以下简称药审中心)发布《中国新药注册临床试验进展年度报告(2023年)》(以下简称《报告》)。《报告》根据药物临床试验登记与信息公示平台的临床试验登记信息,对2023年中国新药注册临床试验现状进行全面汇总和分析,同时对近年来的变化趋势特点进行分析,运用信息化手段助力提升临床试验安全监管能力
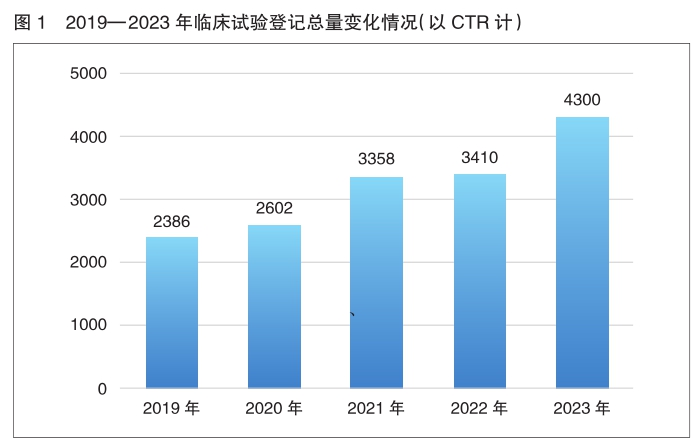
《报告》显示,2023年,药物临床试验登记与信息公示平台登记临床试验总量首次突破4000项,临床试验实施效率进一步改善,启动效率进一步提高
概述
《报告》根据2023年度登记的药物临床试验信息,从临床试验登记总体情况、基本特征信息、各药物类型试验情况、总体实施情况、质量控制情况等方面进行汇总分析,同时对2023年度获批上市创新药临床试验进行概述分析。主要研究成果如下。
新药注册临床试验数量 2023年,药物临床试验登记与信息公示平台登记临床试验总量首次突破4000项,达4300项(以CTR计),为历年登记总量最高,较2022年年度登记总量增长了26.1%,其中新药临床试验(以受理号登记)数量为2323项,与2022年相比,2023年新药临床试验数量增长了14.3%(2323vs. 2033)。
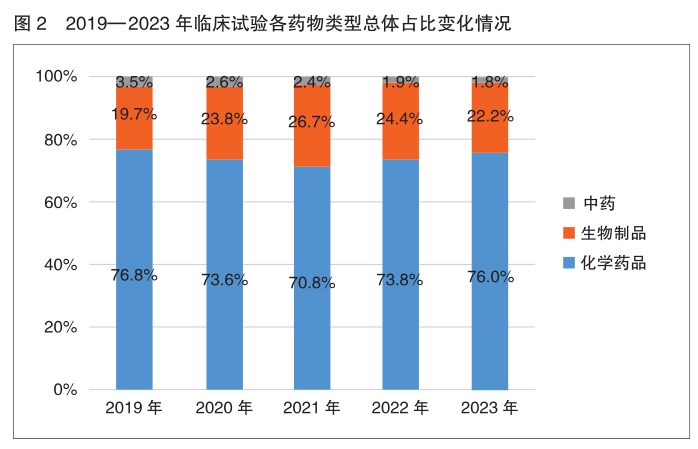
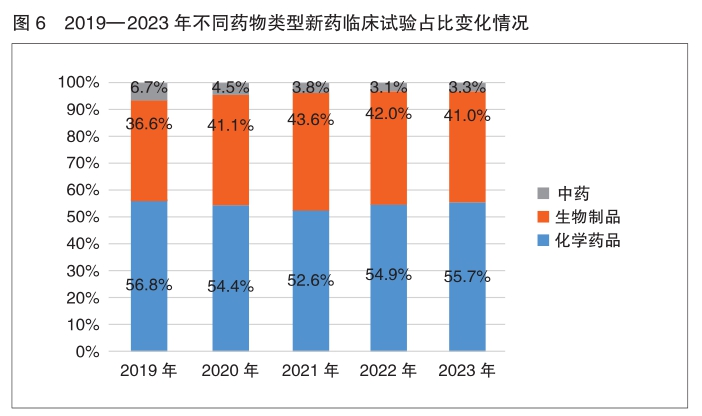
药物类型、注册分类和品种 按化学药品、生物制品和中药分类,近几年来,化学药品和生物制品的新药临床试验占比均较高,化学药品最高,均超过50%,生物制品约为40%。2023年中药占比为3.3%,与2022年基本一致(3.1%)。
从注册分类分析,2023年注册分类为1类的药物共登记1606项试验,占受理号登记试验总体的69.1%(1606/2323),其中化学药品占比最高,为53.7%(862/1606)。1类创新药临床试验继续保持以抗肿瘤药物为主,占总体的40.6%(652/1606)。
2023年共登记81项细胞和基因治疗产品类临床试验,较2022年增长近1倍(46项),以境内的Ⅰ期抗肿瘤药物为主。医学影像学药物临床试验数量共14项,为近年来最多。
试验分类与申办者 按新药临床试验和生物等效性试验(BE试验)分类,2023年新药临床试验占比54.0%,BE试验占比46.0%。境内申办者占比超过90%,达91.7%。
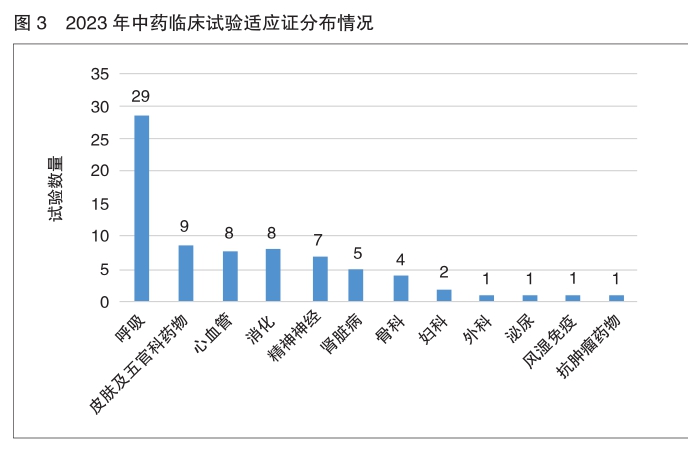
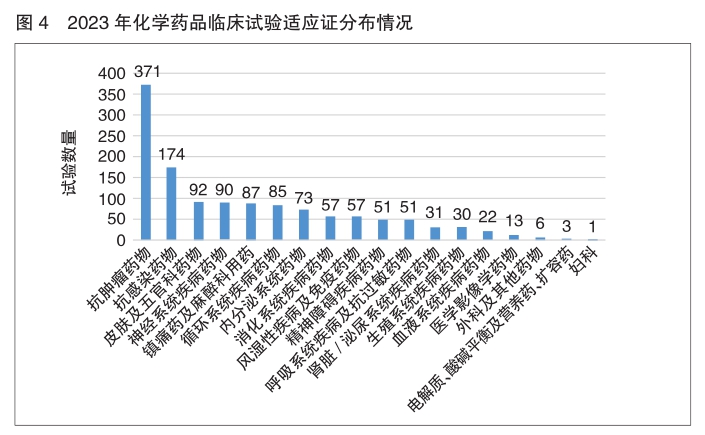
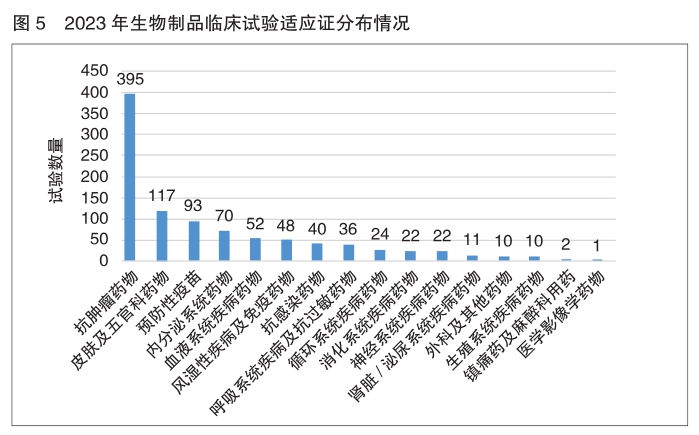
目标适应证与临床试验分期 2023年化学药品和生物制品临床试验的目标适应证主要集中在抗肿瘤领域,其次为抗感染药物、皮肤及五官科药物、神经系统疾病药物、预防性疫苗、内分泌系统药物和血液系统疾病药物。中药主要集中在呼吸、消化、皮肤及五官、精神神经等适应证。
2023年各期临床试验占比总体与2022年基本一致,为Ⅰ期临床试验占比最高,达42.1%;1类创新药临床试验中,Ⅱ、Ⅲ期临床试验占比相较上一年度均出现小幅增加,分别为21.3%和15.8%(2022年分别为20.4%和13.7%)。
在特定人群开展的临床试验中,仅在儿童人群中开展的临床试验有104项,与2022年相比增加了62.5%(104项 vs. 64项)。罕见疾病药物临床试验数量呈现显著增长趋势(119项 vs. 68项),且适应证领域进一步扩大,包括抗肿瘤药物、血液系统疾病、神经系统疾病、呼吸系统疾病及抗过敏药物和风湿性疾病及免疫药物。
临床试验地域分布分析 2023年临床试验组长单位和参加单位以北京市、上海市、江苏省、湖南省、广东省等为主。儿童临床试验组长单位主要集中在北京市。
临床试验登记、审核和实施效率分析 以受理号登记的试验和以BE备案登记的临床试验登记平均用时分别为78.5天和16.6天,1个月以内完成试验登记并提交的占比分别为28.7%和84.9%。
2023年共计接收4217项首次登记任务,总体审结率为99.9%。如以审核时限15个工作日进行分析,时限内首次登记任务审结率为100%。
2023年,新药临床试验可在6个月内启动受试者招募的比例继续保持小幅提高,总体占比达56.3%。结合临床试验机构所在地分析,临床试验组长单位较多的省、区、市,其临床试验的启动用时较长。
若仅对试验获批后当年启动受试者招募情况进行分析,与2022年相比,2023年启动招募的用时进一步缩短,平均为3.0个月(2022年平均为3.3个月),6个月内启动招募的比例也进一步提高,达93.4%(2022年为91.5%)。
年度上市新药分析 2023年度共批准40个创新药,国内上市许可持有人占比超过90.0%。创新药以化学药品和生物制品为主,分别为19个(47.5%)和16个(40%)品种,其中抗肿瘤药物共14个(35%)品种。中药共批准5个品种,涉及皮肤及五官、消化、呼吸和精神神经适应证领域。2023年度创新药获准上市所用时间平均为7.2年,与上一年度基本一致。
结论
药物临床试验登记与信息公示平台年度登记总量创历史新高,首次突破4000项,较2021年首次突破3000项后增长了近1000项。国内药企继续保持较高的研发热情,2023年首次公示的临床试验中,境内申办者占比超过90%。药品注册分类主要以1类为主,约占总体的70%,中药、化学药品1类新药占比分别为31.6%和66.6%,治疗用和预防用生物制品1类新药占比分别为79.2%和49.6%。
1类创新药总体处于研发早期阶段,2023年Ⅰ期临床试验占比为47.1%。与上一年度相比,1类创新药Ⅰ期临床试验占比出现小幅下降,Ⅱ、Ⅲ期临床试验占比均呈现小幅增加。
化学药品和生物制品临床试验主要针对肿瘤适应证,占1类创新药总体的40.6%。与上一年度相比,2023年1类抗肿瘤创新药Ⅰ期和Ⅲ期临床试验数量继续保持小幅增长。
细胞和基因治疗产品类临床试验数量为81项,较2022年增长近1倍,共涉及70个品种。罕见病临床试验数量逐年增加,较2022年增加了42.9%,适应证领域进一步扩大。医学影像学和放射性药物临床试验数量保持小幅增加。
2023年仅在儿童人群中开展的临床试验数量和在新药临床试验中的占比均增长,且Ⅲ期临床试验占比最高。中药主要以呼吸适应证为主,化学药品主要为皮肤及五官科,生物制品主要为预防性疫苗。
申请人试验实施效率进一步改善,完成首次试验登记用时较长,但较上一年度平均登记用时有所缩短,1个月内完成登记并提交的占比均有所提高。与2022年相比,2023年临床试验启动效率进一步提高,平均启动用时进一步缩短。总体上6个月内启动受试者招募比例达56.3%,2023年当年获批临床试验且在6个月内启动受试者招募比例达93.4%。
2023年度上市创新药继续保持以国内持有人为主,抗肿瘤药物占主体,上市平均用时与2022年基本持平。
综上,中国新药临床试验数量继续保持逐年增加态势,临床试验实施效率和质量逐步提高,创新与高效并存,我国创新药行业仍有较大发展空间,随着我国鼓励创新政策的积极引导,对研发企业主动靠前服务等举措,将进一步加快新药上市,更好地满足中国患者的用药需求。
第一章
药物临床试验登记总体概况
2023年中国药物临床试验年度登记总量首次突破4000项,达4300项(以CTR计,下同),与2022年相比增长了26.1%,其中受理号登记2323项,BE备案号登记1977项。
按药物类型中药、化学药品和生物制品统计,2023年中国药物临床试验以化学药品为主,占比为76.0%;其次为生物制品,为22.2%;中药为1.8%。对比分析近五年来数据,各类药物临床试验数量占比类似,略有浮动。
第二章
临床试验基本特征信息分析
一、申办者类型
根据受理号对申办者类型进行分析,即受理号首字母为J的按境外申办者,其他为境内申办者进行统计。2023年度登记的临床试验中,以境内申办者为主,占比为91.7%(3941项)。与2022年相比,境外申办者占比下降了3.2%。
二、药物类型及注册分类
中药 2023年共登记76项临床试验,主要以原注册分类6类和1类为主,占比分别为34.2%和31.6%,其次为2类,占比为17.1%。
化学药品 对于以受理号登记的新药临床试验,以注册分类1(含原注册分类)的药物占比最大,达66.6%,其次为2类,占比为19.8%。
生物制品 2023年治疗用生物制品以1类和2类(含原注册分类)为主,占比分别为79.2%和10.3%;预防用生物制品以1类和3类为主,占比分别为49.6%和19.7%。
三、目标适应证
中药 2023年中药新药临床试验主要集中在呼吸、皮肤及五官、心血管、消化和精神神经5个适应证领域,约占中药临床试验总体的80.3%,其中呼吸适应证占比最大,为38.2%。
化学药品 2023年化学药品适应证以抗肿瘤药物为主,占化学药品临床试验总体的28.7%,其次分别为抗感染药物(13.5%)、皮肤及五官科药物(7.1%)、神经系统疾病药物(7.0%)和镇痛药及麻醉科用药(6.7%)。
生物制品 2023生物制品适应证同样以抗肿瘤药物为主,占生物制品临床试验总体的41.5%,其次分别为皮肤及五官科药物(12.3%)、预防性疫苗(9.8%)、内分泌系统药物(7.3%)和血液系统疾病药物(5.5%)。
四、临床试验类型与分期
1.新药临床试验
按新药临床试验(以受理号登记)和生物等效性试验(BE试验,以备案号登记)来统计,2023年新药临床试验登记2323项(54%),较2022年的1974项增加约17.7%;BE试验登记1977项(46%),较2022年的1436项增加约37.7%。
2023年以受理号登记的新药临床试验中,化学药品、生物制品和中药分别登记1294项(55.7%)、953项(41.0%)和76项(3.3%)。对比近年来新药临床试验登记数据,各类药物历年占比情况保持一致,均为化学药品最多(超过50%),其次为生物制品(40%左右),中药占比较2022年有小幅增长。
2.生物等效性试验及品种
2023年度BE试验数量前10位品种中,富马酸伏诺拉生片、替米沙坦氨氯地平片和他达拉非片登记试验数量最多,分别为38项、26项和25项。
与2022年相比,前10位品种中相同品种有3个,分别为他达拉非片、利丙双卡因乳膏和阿司匹林肠溶片,并且他达拉非片为近三年的前3位品种之一。
3.临床试验分期
在2023年以受理号登记的新药临床试验中,Ⅰ期占比为42.1%(978项),Ⅱ期和Ⅲ期占比分别18.9%(440项)和21.1%(489项),Ⅳ期临床试验有62项(主要为上市批件中明确要求开展的临床试验)。对于不能完全以Ⅰ~Ⅳ期划分的,按“其他”进行统计,如Ⅰ/Ⅱ期等。
各期临床试验占比与2022年基本一致,均为Ⅰ期临床试验占比最高,其次为Ⅲ期和Ⅱ期,Ⅳ期占比最低。
对比近三年临床试验数据,各期临床试验占比总体变化不大,其中Ⅰ期和Ⅲ期临床试验占比分别为40%和20%左右。
第三章
各药物类型临床试验分析
一、中化生新药临床试验概况
按照不同药物类型分别对2023年度2323项新药临床试验所涉及的品种(按临床试验许可文件药品名称)数量进行统计,结果如下。
中药 2023年共登记76项临床试验,与近年来中药品种临床试验进展情况基本一致。2023年获批开展临床试验并完成临床试验信息登记有7个品种的9项临床试验。开展2项以上临床试验的品种包括苏黄止咳颗粒(3项)、泽泻降脂胶囊(2项)、紫辛鼻鼽颗粒(2项)和通利肠溶胶囊(2项)。
化学药品 2023年化学药品临床试验数量前10位品种共登记95项试验,占化学药品总体7.3%(95/1294),以阿兹夫定片开展的试验数量最多,达21项。从适应证领域分析,前10位品种中抗感染药物和抗肿瘤药物试验共59项,涉及9个品种。
生物制品 2023年生物制品开展临床试验数量前10位品种共登记88项试验,占生物制品总体9.2%(88/953),以治疗用生物制品为主,共涉及10个品种78项试验(88.6%);预防用生物制品涉及2个品种10项试验(11.4%)。抗肿瘤药物试验有36项,涉及4个品种。 (下转3版)