随着制药产业链内部的分工日益呈现出专业化、精细化及定制化的特征,以合同研发与生产组织(CDMO)为代表的医药合同外包服务产业应运而生,并迅速崛起为全球医药产业中不可或缺的一环。
创新药行业的蓬勃兴起为CDMO行业提供了广阔的发展空间,而CDMO企业则依托其规模化生产能力与高技术附加值的研发生产工艺,成为协助制药企业跨越从药物概念到上市、从工艺研发到大规模生产全链条的关键合作伙伴。
助力企业降本增效CDMO服务备受青睐
伴随着新药研发难度和成本的增加,越来越多的制药企业选择将研发和生产环节外包给专业的CDMO企业。CDMO深度融入制药企业的研发生产价值链中,精准把握并满足药企对于外包服务的核心诉求点,包括提升研发生产效率、降低成本、优化资源配置以及促进技术迭代等。
CDMO的业务模式以订单为导向,既深度挖掘大型Biopharma(生物制药企业)核心客户的需求,又积极加速拓展中小型Biotech(生物科技公司)市场,通过构建市场覆盖广度(大型药企规模化订单)与客户服务深度(创新型Biotech全周期服务),强化灵活产能配置与技术转化能力。
对于Biopharma来说,其产品管线分布于不同发展梯度,且后期对规模化生产需求显著。在运营过程中,Biopharma需统筹协调研发、生产与商业化等多维资源配置,保障全链条高效运转。面对日益激烈的市场竞争与持续攀升的成本压力,当前Biopharma正积极向轻资产运营模式转型——通过剥离生产职能、依托外包服务,实现降本增效的目标。
对于数量众多的Biotech来说,其更多专注于药物创新领域,尤其是前期临床研发阶段,但在工艺开发、商业化生产等全产业链中后端环节存在显著的能力缺口。受限于资金规模与风险承受能力,加之自建产能耗时久、投入大,Biotech普遍面临生产工艺与技术积累不足的挑战。借助CDMO服务,Biotech可将有限资源聚焦于核心研发环节,有效突破中后端瓶颈,加速完成从研发到生产的转化进程。
CDMO行业持续扩容全球不同区域各具特色
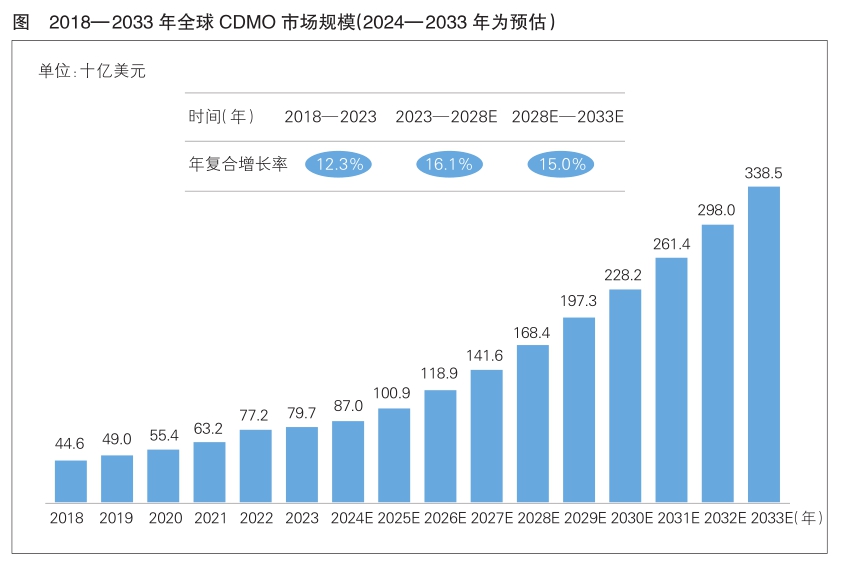
全球医药CDMO行业保持较高的市场景气度,2018—2023年,全球CDMO市场规模从446亿美元增长至797亿美元,年复合增长率为12.3%(详见图)。
全球市场对创新药的需求不断上升,创新药尤其是生物制品中的新兴疗法得到快速发展,制药企业对CDMO服务的需求也随之增加。
为了降低成本、提高效率并专注于核心业务,越来越多的创新药企业选择将部分研发和生产环节外包给专业的CDMO企业。全球医药CDMO行业的市场规模预计在2028年和2033年分别达到1684亿美元和3385亿美元。
从地域分布来看,欧洲以生物制药CDMO的高质量服务著称,尤其在细胞与基因治疗领域。德国、瑞士等国家的CDMO企业在病毒载体生产、基因疗法开发方面技术领先。为了响应日益严格的环保法规,并满足市场对绿色和可持续产品的需求,欧洲越来越多的CDMO企业开始积极制定并实施绿色生产计划。美欧的贸易关系时有波动,关税政策的不确定性给依赖出口的CDMO企业带来了潜在风险,特别是那些在爱尔兰、德国等地设有生产基地,并大量向美国出口产品的CDMO企业。
美国长期占据全球CDMO市场的主导地位,其优势源于成熟的医药产业链、高研发投入和大型跨国药企的集中布局,自动化、智能化技术应用广泛。近年来,美国政府推动“制造业回流”,默沙东、礼来等药企宣布在美国扩建生产基地,可能导致部分CDMO订单回流。但美国对全球供应链高度依赖,许多关键原料、中间体和生产技术都来自其他国家。
印度是全球主要的仿制药供应国之一,积累了一定的研发生产经验和技术能力,拥有低成本竞争力,且地缘政治红利显著。印度CDMO市场通过产能扩张、技术升级与国际合作,逐步成为全球医药供应链的核心节点。例如,本土医药外包(CXO)企业联合成立创新制药服务组织(IPSO),旨在提升印度在全球市场的竞争力,争取更多国际订单。但印度需持续应对人才储备短缺,以及水、电供应不稳定等基础设施短板。
中国拥有完整的医药供应链,劳动力成本较低,产品覆盖小分子、大分子全领域,具备“药物发现+商业化生产”一体化服务能力,可为全球市场提供高质量且高性价比的CDMO服务。在全球化布局方面,中国企业正积极通过海外建厂或并购等方式拓展欧美市场,如药明康德收购OXGENE、康龙化成收购Cramlington生产基地便是典型案例。在行业整合层面,头部效应日益显著,出现药明康德、药明生物、凯莱英、康龙化成等龙头企业。此外,在此背景下,以药石科技为代表的CDMO企业也纷纷转向差异化策略以寻求突破,其凭借分子砌块资源反向整合以及全球认可的低碳技术占据竞争优势。
紧贴研发生产需求CDMO行业逐步细分
从细分领域来看,小分子化药在获批上市的药物类型中占比最大,在全球药物市场占据重要位置,研发生产需求旺盛。小分子化药研发迈入高技术壁垒创新阶段,而CDMO行业通过连续流反应等技术,突破传统生产模式,可提升小分子化药开发的效率与安全性,驱动行业升级。
基于化学药的成药性质,小分子化药易规模化生产,受益于全球产业链转移以及国内创新药研发热度上升,我国小分子化药CDMO近年来承接了大量订单;但国内企业多提供API(原料药)生产所需的中间体,业务附加值低,且单产品市场空间小。随着制剂技术的日渐完善,我国小分子化药CDMO企业向高附加值的产业链下游延伸的空间较大,将服务内容由中间体供应向高级中间体、API甚至制剂的生产发展,CDMO市场有望进一步扩大。2018年至2023年,我国小分子化药CDMO市场规模从118亿元增长至599亿元,预计2028年将达到1274亿元。
在多肽领域,全球多肽市场规模以GLP-1类药物为引领快速扩容,以8.1%的年复合增长率从2018年的607亿美元扩大至2023年的895亿美元。随着多肽药物在医药领域的广泛应用和认可,越来越多的企业和研究机构投入到多肽药物的研发中,并选择将生产环节外包给专业的CDMO公司,以降低成本和提高效率。与此同时,CDMO公司在多肽药物生产方面的技术进步和创新,如新型合成技术、纯化工艺和质量控制体系的建立,提高了多肽药物的产量和质量,满足了市场对高质量多肽药物的需求。
2015—2024年,我国多肽药物的研发始终维持着较高热度,其临床试验登记数量保持增长态势,在10年内实现了0到153项的突破。2021年和2023年分别出现了两次快速增长,当年开启的临床试验数量分别攀高到105项和124项,同比增幅分别达到54.4%和65.3%。2018—2023年,我国多肽CDMO的市场规模以28.2%的年复合增长率从10亿元增长至36亿元,预计2023—2028年的年复合增长率将达到30.0%。
近年来,以抗体为代表的一系列生物制品已经逐渐成为全球医药产业的发展重心,治疗性抗体市场规模持续上升。生物大分子结构复杂、研制标准严苛、配方分析技术难度升级,符合生产质量管理规范(GMP)要求的药物,制造技术壁垒较高,制药企业难以完全掌控生物制剂开发过程中的全部技能和风险;与此同时,商业化生产的法规日益严格,合规性要求使小型生物制剂研发服务供应商面临挑战。
CDMO企业凭借迭代的工艺平台和丰富的项目经验可提供技术支持,同时满足监管机构对于企业在产品质量、安全上的合规要求。2018—2023年,我国大分子CDMO市场规模从42亿元增长至261亿元,年复合增长率为44.2%。预计2028年市场规模将达到809亿元,年复合增长率逐渐放缓至25.4%,但整体市场规模仍在不断扩大。
在ADC(抗体偶联药物)领域,全球市场规模从2022年的79亿美元增长至2024年的141亿美元,预计这一增长趋势将继续保持。我国ADC领域投融资活跃,出海步伐加快,显示出强劲的发展势头与更高的国际认可度。
ADC CDMO的发展正被三大核心因素强力驱动。首先,ADC药物技术历经三代革新,在靶点、抗体、连接子、毒素及偶联方式等方面均有显著突破,提升了药物的稳定性和抗肿瘤活性。技术迭代优化了药物性能的同时也在拓展其适应证范围。其次,ADC生产过程复杂,涉及多个环节,对技术、设备和质量控制要求极高,药企为降低成本和风险,倾向于将生产外包给专业的CDMO企业。最后,全球ADC市场中的大型药企通过并购与合作积极布局。产品迭代升级提升ADC药物竞争力,生产壁垒促使药企依赖CDMO专业服务,而交易火热则推动市场规模扩张。三者协同作用,驱动ADC CDMO市场快速增长,2018—2022年,市场规模从0.1亿美元扩大至2.1亿美元。预计未来市场将持续整合升级,且技术创新与产能扩展将成为企业制胜关键,2026年市场规模或将达到8.3亿美元。
全球每年启动的CGT(细胞和基因疗法)临床试验数量持续攀升,从2019年的249项增长至2024年的563项,反映产业界对CGT领域未来发展的乐观预期和不断加大的研发投入。预计有更多CGT研发企业选择与CDMO企业达成合作,以集中精力进行核心的药物研发工作。
相比传统制品,CGT产品对CDMO的依赖度更高,且布局CGT赛道的初创企业较多,研发投入上能力有限,外包意愿更为强烈。由于临床后期的工艺确认完成后更换平台的成本高昂,CGT产品的客户黏性较大,早期介入后将更有望获得商业化订单销售放量。2018—2023年,我国CGT CDMO市场规模从10亿元增长至19亿元,预计2028年可达到64亿元。
延伸阅读
我国CDMO行业发展的四个阶段
第一阶段:产业萌芽期(1980—2015年)
该阶段,在外资企业技术输入、本土企业探索和政策松绑三重驱动下,CDMO行业完成初步的基础产能建设和技术标准接轨。
改革开放以后,跨国药企加速在华进行本土化布局,建立生产基地并外包部分生产环节,带动本土企业承接原料药和中间体订单。与此同时,技术外溢效应产生,外资企业引入GMP标准、质量管理体系和生产工艺,推动本土制造升级。
2000年,药明康德作为中国第一批一体化CRO/CDMO企业,早期聚焦化学合成服务,承接跨国药企小分子药物中间体研发生产订单,并于2007年在美股纽交所上市,进一步验证本土CDMO商业模式可行性,形成了行业示范效应。
2015年8月,国务院发布《关于改革药品医疗器械审评审批制度的意见》,首次提出开展药品上市许可持有人(MAH)制度试点。上市许可与生产许可分离的模式打破了传统的“自研自产”,为CDMO的发展提供了制度基础。
第二阶段:快速成长期(2016—2020年)
该阶段,CDMO行业完成从仿制药向创新药、从化学药向生物药、从国内向国际的三重升级。
行业升级的背后离不开政策的推动。一是顶层设计释放制度红利。例如,新修订《中华人民共和国药品管理法》的实施,推动MAH制度全国落地,允许研发机构及Biotech企业委托生产,直接催生轻资产药企的外包需求爆发。二是供给侧结构性改革倒逼产业升级。例如,2017年起环保监管趋严,原料药与CDMO企业面临严格的环境、健康与安全(EHS)审查,倒逼行业向高技术、低污染模式转型。三是支付端压力加速成本重构,向CDMO转移产能成为药企维持利润的必然选择。
我国生物药创新浪潮的兴起直接推动了CDMO行业的发展。与此同时,CGT领域的爆发性增长重塑了CDMO服务生态。
本土CDMO企业的国际化进程也在这一阶段萌芽。以药明生物为代表,其于2019年成为国内首家同时获得美国食品药品管理局与欧洲药品管理局双重认证的CDMO企业。
第三阶段:爆发期(2021—2023年)
该阶段,我国CDMO行业在资本、技术与政策共振下,从“规模扩张”转向“生态竞争”。
资本注入促进行业繁荣。大量资金流向CDMO行业,2020—2023年,共发生151起融资事件,融资总金额达到227.7亿元。此外,我国CDMO企业展现出良好的盈利能力和增长潜力,在二级市场投资者的持续看好下,其股价和市盈率一路攀升。
新兴疗法驱动需求重构,生物药CDMO快速发展。CGT、ADC、核酸药物等新兴领域更加注重创新性和差异化,相关技术的突破催生了更加细分化、专业化的CDMO。
我国企业在ADC药物的靶点选择、结构优化上展现创新力,获海外药企认可。而ADC的研发热潮也正带动CDMO拓展业务布局,从早期研发延伸至商业化生产,提供抗体、Linker-Payload、偶联反应到制剂的系列服务。
人才结构优势构成全球竞争力的核心要素。CDMO行业提供从药物发现到商业化生产的全链条技术服务,源于其知识密集型本质和技术驱动特性,对人才的需求旺盛。而我国CDMO行业具有显著的人才供给优势,研发人员普遍具备生物医学本科以上背景,硕士及以上学历占比高,且部分核心团队拥有国际一流研发经验。
第四阶段:进阶期(2024年至今)
该阶段,中国CDMO行业正式步入“技术深耕、全球布局、生态整合”的新阶段,但需应对地缘政治、产能过剩与技术颠覆的多重挑战。头部企业通过全球化布局、技术壁垒构建与绿色转型,有望在全球医药产业链中占据更重要的位置,并有望跻身全球第一梯队。中小企业则需通过差异化与创新实现突围。此外,AI技术与智能工厂也将深度应用于CDMO行业,赋能药物研发全生命周期,包括靶点发现与筛选、工艺优化以及规模化生产等。
(本版稿件由弗若斯特沙利文提供)