(上接2版)
2.化学药品注册申请审结情况
2024年审结化学药品注册申请9759件,按注册申请类别统计,临床试验申请1994件,NDA 230件,ANDA 3552件,一致性评价申请1135件,补充申请2449件,境外生产药品再注册申请399件。
(1)新药临床试验申请和新药上市申请
批准化学药品IND 1652件,以注册分类统计,包括创新化学药品IND 1247件(538个品种)、改良型化学药品IND 405件(219个品种);建议批准化学药品NDA 204件(123个品种),以注册分类统计,包括创新化学药品NDA 41件(29个品种)、改良型化学药品NDA 58件(32个品种)、5.1类化学药品NDA 105件(62个品种)。
批准的化学药品IND 1652件中,抗肿瘤药物占41.89%,皮肤及五官科药物占11.08%,内分泌系统药物占6.84%。
建议批准的化学药品NDA 204件中,抗肿瘤药物占36.27%,内分泌系统药物占10.78%,神经系统疾病药物占9.31%。
(2)化学仿制药上市申请
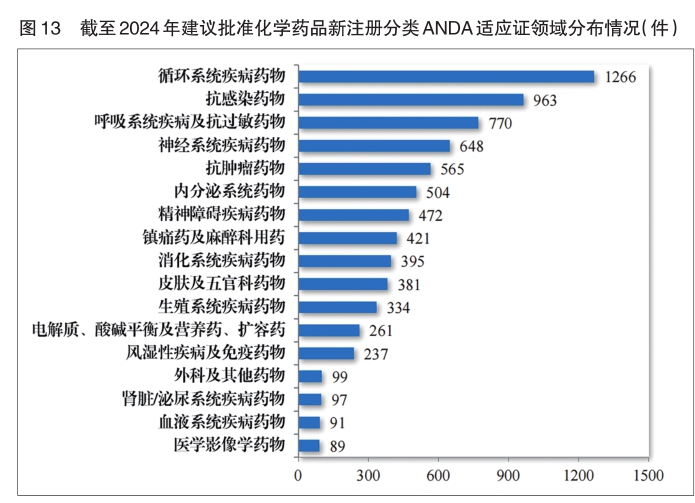
2024年建议批准化学仿制药上市申请3041件,其中首仿品种289个,有效满足了临床患者对高质量仿制药的需求。
化学药品注册分类改革以来,药审中心按照与原研药品质量和疗效一致性的要求,累计建议批准化学仿制药7593件,涉及循环、抗感染、呼吸等17个治疗领域。
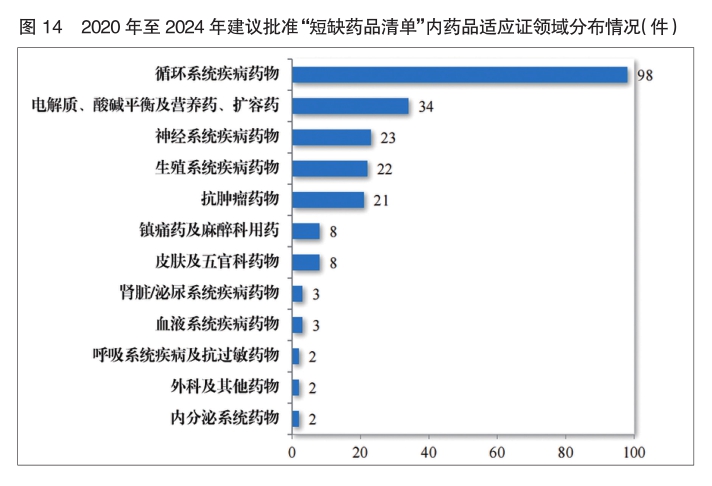
为落实《国务院办公厅关于进一步做好短缺药品保供稳价工作的意见》,2020年,国家卫生健康委等12部门联合发布了国家短缺药品清单。2024年,药审中心共建议批准“国家短缺药品清单”内药品117件(21 个品种)。近五年累计建议批准短缺药品共226件(30个品种),涉及循环、电解质、神经、肿瘤和生殖等12个治疗领域,有效保障了短缺药品的供应。
为进一步促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,自2016年起,国家卫生健康委会同有关部门研究制定了五批鼓励研发申报儿童药品清单,共有160个品种,包括口服溶液剂、口服混悬剂、颗粒剂等适宜儿童给药剂型。2024年,药审中心建议批准鼓励研发申报儿童药品清单内的儿童用仿制药17件(14个品种)。近五年累计建议批准鼓励研发申报儿童药品清单内的儿童用仿制药59件(26 个品种),涉及神经、抗肿瘤、内分泌等8个治疗领域。
(3)化学仿制药质量和疗效一致性评价工作
2024年,药审中心持续推进化学仿制药质量和疗效一致性评价工作,为患者提供高质量仿制药,共发布参比制剂目录13批,涉及929个品规(161个品种)。截至2024年12月31日,累计发布87批参比制剂目录,共7643个品规(2677个品种)。
2024年批准一致性评价申请1011件(354个品种),其中口服固体制剂302件(180个品种)、注射剂709件(174个品种)。自化学仿制药质量和疗效一致性评价工作开展以来,累计批准一致性评价申请共4805件(共计756个品种),其中口服固体制剂2137件(计465个品种)、注射剂2668件(计291个品种)。
3.生物制品注册申请审结情况
2024年,审结生物制品注册申请2247件,包括预防用生物制品184件、治疗用生物制品2054件和体外诊断试剂9件。
按注册申请类别统计,IND 1157件,NDA 193件,补充申请833件,境外生产药品再注册申请64件。
(1)预防用生物制品
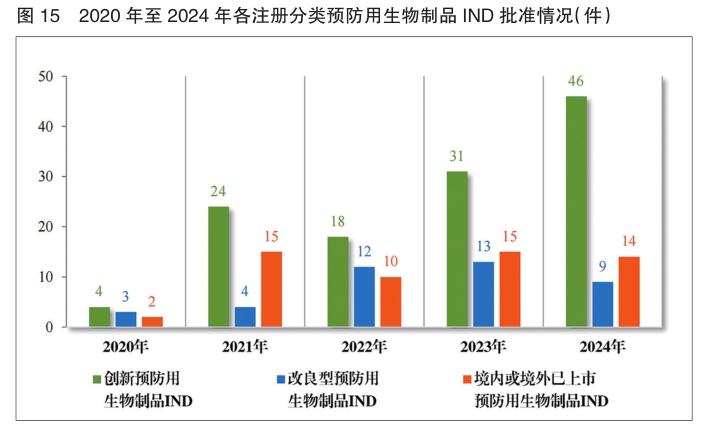
批准预防用生物制品IND 69件,以注册分类统计,包括创新预防用生物制品IND 46件(33个品种)、改良型预防用生物制品IND 9件(7个品种)、境内或境外已上市预防用生物制品IND 14件(12个品种);建议批准预防用生物制品NDA 7件(3个品种),以注册分类统计,均为境内或境外已上市预防用生物制品。
(2)治疗用生物制品
批准治疗用生物制品IND 985件,以注册分类统计,包括创新治疗用生物制品IND 798件(531个品种)、改良型治疗用生物制品IND 112件(57个品种)、境内或境外已上市治疗用生物制品IND 75件(36个品种)。
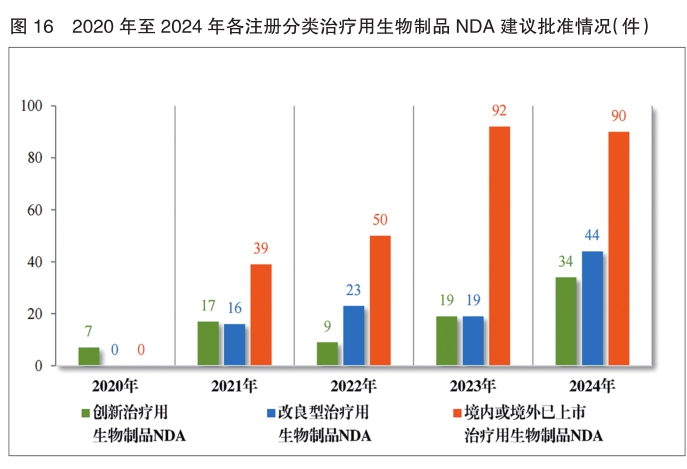
建议批准治疗用生物制品NDA 168件,以注册分类统计,包括创新治疗用生物制品NDA 34件(24个品种),改良型治疗用生物制品NDA 44件(23个品种),境内或境外已上市治疗用生物制品NDA 90件(49个品种),其中包括生物类似药(3.3类)25件(15个品种)。
批准的治疗用生物制品IND 985件中,抗肿瘤药物占比55.43%,皮肤及五官科药物占比10.66%,内分泌系统药物占比7.31%。
建议批准的治疗用生物制品NDA 168件中,抗肿瘤药物占比37.50%,内分泌系统药物占比15.48%,血液系统疾病药物12.50%。
(三)直接行政审批类注册申请审结情况
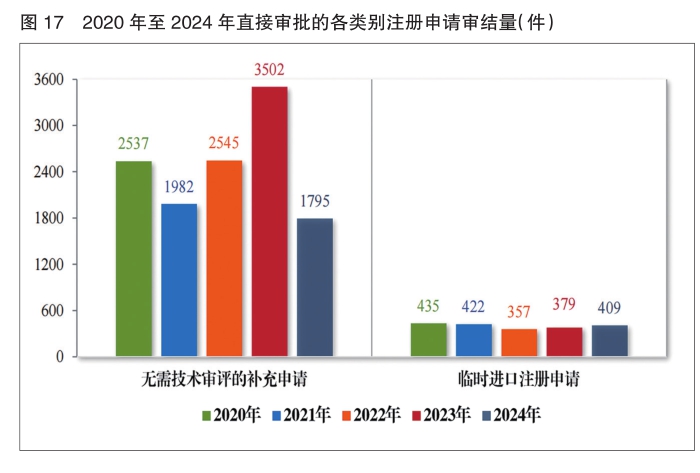
2024年审结直接行政审批类注册申请2204件,其中无需技术审评的补充申请1795件,临时进口注册申请409件。
第三章 药品加快上市注册情况
2024年药审中心通过药品加快上市注册程序,加强与申请人的沟通交流,缩短药物研发与技术审评时间,加快临床急需新药好药上市。
(一)突破性治疗药物程序
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。对于纳入突破性治疗程序的药物,其临床试验期间沟通交流包括首次沟通交流、因重大安全性问题/重大技术问题而召开的会议、药物临床试验关键阶段会议以及一般性技术问题咨询等,药审中心优先配置资源进行沟通交流,加强指导并促进药物研发。
2024年共收到突破性治疗药物程序申请337件,同意纳入突破性治疗药物程序91件(84 项适应证),占申请数量的27.00%,较2023年增加30.00%。
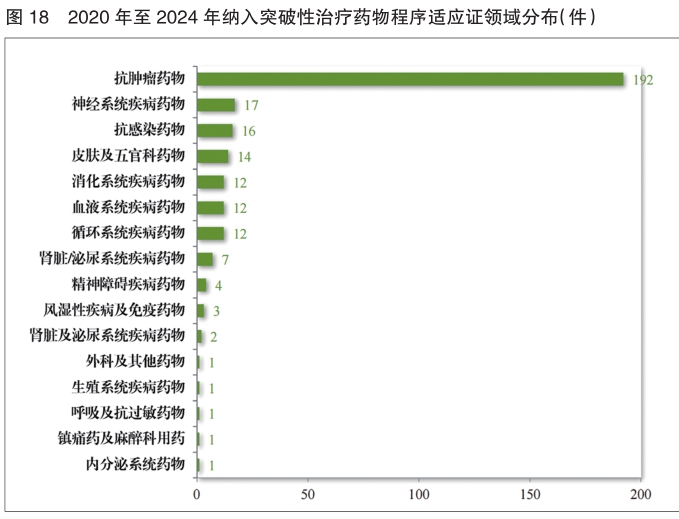
自2020年新修订《药品注册管理办法》实施以来,累计纳入突破性治疗药物程序294件(246项适应证),排名前三的分别为抗肿瘤药物、神经系统疾病药物及抗感染药物。
(二)附条件批准程序
药物临床试验期间,治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,以及应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委认定急需的其他疫苗,经评估获益大于风险的,可基于替代终点、中间临床终点或早期临床试验数据而附条件批准上市。附条件批准上市的目的是缩短药物临床试验的研发时间,使其尽早应用于无法继续等待的危重疾病或公共卫生方面急需的患者。
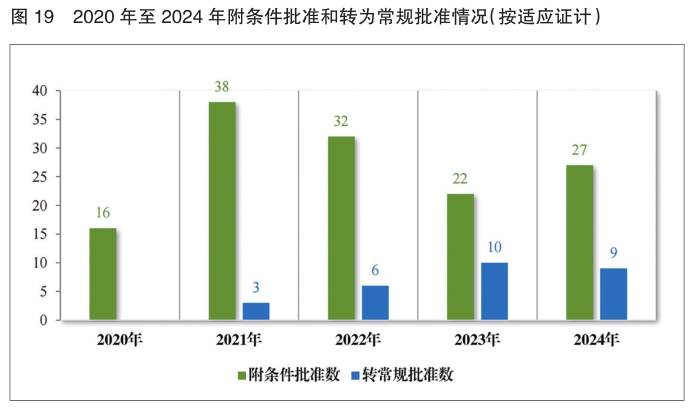
2024年共有37件药品注册申请(27项适应证)附条件批准上市。其中,18项适应证为首次批准上市,9项适应证为已上市药品增加适应证。同时,在2024年,共有9项附条件批准的适应证完成确证性研究,转为常规批准。
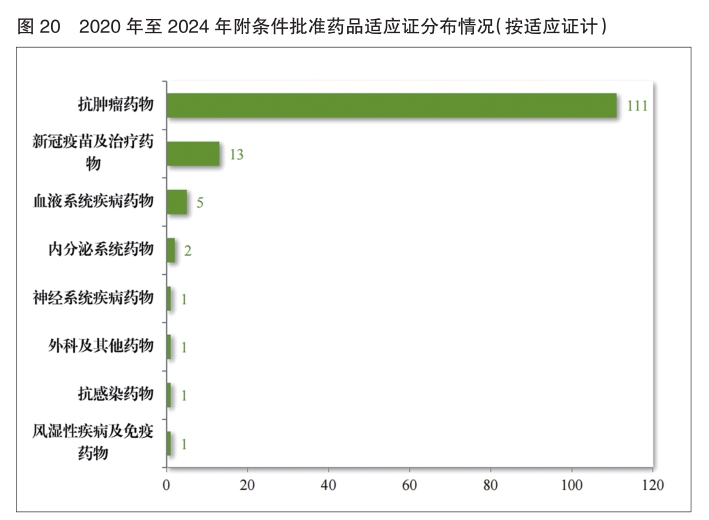
自 2020 年新修订《药品注册管理办法》实施以来,共有187件药品注册申请(135项适应证)附条件批准上市,包括抗肿瘤药物、新冠疫苗及治疗药物、血液系统疾病药物等,其中抗肿瘤药物数量最多,占比82.22%,共有28项附条件批准的适应证完成确证性研究,转为常规批准。
(三)优先审评审批程序
药品上市许可申请时,对于以下具有明显临床价值的药品,可以申请适用优先审评审批程序:(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;(二)符合儿童生理特征的儿童用药品新品种、剂型和规格;(三)疾病预防、控制急需的疫苗和创新疫苗;(四)纳入突破性治疗药物程序的药品;(五)符合附条件批准的药品;(六)国家药监局规定其他优先审评审批的情形。适用优先审评审批程序的上市注册申请的审评时限由常规程序的200日缩短为130日,其中临床急需境外已上市罕见病用药的审评时限为70日。
2024年共纳入优先审评审批注册申请124件(88个品种),同比增加14.81%;2024年按照优先审评审批程序批准110件注册申请(74个品种,其中2个品种新准上市后,同年又批准新适应证)上市,同比增加 29.41%。
自2020年新修订《药品注册管理办法》实施以来,共有496件药品注册申请纳入优先审评审批程序,包括抗肿瘤药物、皮肤及五官科药物、内分泌系统药物等,其中抗肿瘤药物数量最多,占比42.54%。
第四章 药品研发与审评沟通交流
沟通交流是在药物研发与注册申请过程中,申请人与药审中心就关键技术问题等所进行的沟通交流,是药审中心鼓励药物创新,提高审评审批质效,促进医药产业高质量发展的重要举措之一。
(一)沟通交流会议申请与办理情况
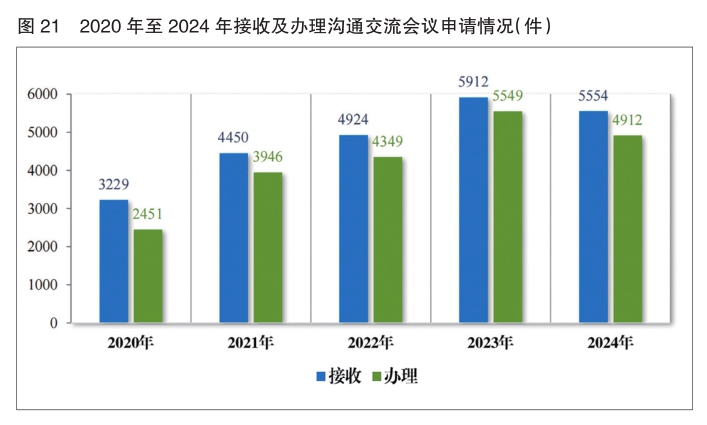
2024年药审中心共接收沟通交流会议申请5554件,办理沟通交流会议申请4912件,为1575家企业的3551个品种(按照申请人提交沟通交流申请时的药品名称计,下同)提供了沟通交流服务,其中召开面对面会议/电话会议691个,同比增加12.91%。
2024年,药审中心办理沟通交流会议申请4912件,在药物研发关键阶段办理的Ⅱ类会议占比56.05%,其中新药临床试验申请前(Pre-IND)沟通交流会议申请占比20.64%,新药上市许可申请前(Pre-NDA)沟通交流会议申请占比10.36%。
(二)一般性技术问题咨询情况
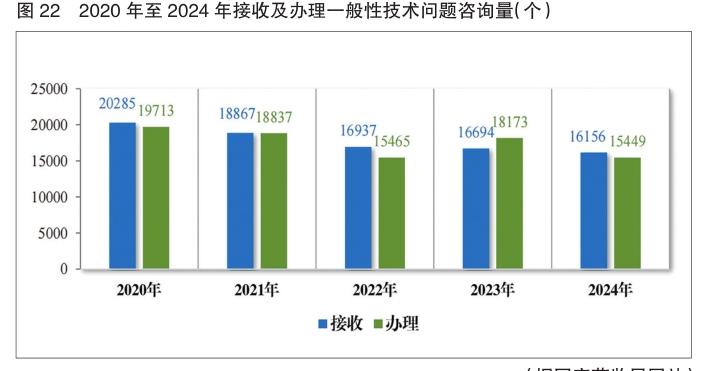
2024年接收一般性技术问题咨询16156个,为3590家企业解答一般性技术问题咨询15449个,及时总结梳理共性问题,并在药审中心网站予以发布,2024年按程序发布7批共31个常见一般性技术问题解答,涵盖了注册受理、技术审评等方面,累计发布240个共性问题。
(据国家药监局网站)