(上接6版)
(五)进口医疗器械国别情况
2024年,共有33个国家(地区)产品在我国获批上市。
其中,美国、德国、日本、韩国、法国医疗器械在我国医疗器械进口产品首次注册数量位列前五位,注册产品数量约占2024年进口产品首次注册总数量的78%,与2023年相比略有增加。
从进口医疗器械代理人分布看,共有21个省份涉及有本省份企业作为进口医疗器械代理人,其中上海市的进口医疗器械代理人代理的进口医疗器械首次注册数量最多,占全部进口医疗器械首次注册数量的65%,与2023年相比略有增加。
(六)境内第三类医疗器械首次注册省份分析
从2024年境内第三类医疗器械首次注册情况看,相关注册人主要集中在沿海经济较发达省份。
其中,江苏、广东、北京、上海、浙江是境内第三类医疗器械首次注册数量排前五名的省份,占2024年境内第三类医疗器械首次注册数量的68%,与2023年相比基本持平。
四、创新医疗器械等产品注册审批情况
2024年,国家药监局按照《创新医疗器械特别审查程序》《医疗器械优先审批程序》继续做好相关产品的审查审批工作,共收到创新医疗器械特别审查申请451项,比2023年减少3.2%。
从2014年至2024年,国家药监局共批准315个创新医疗器械。
其中,境内创新医疗器械272个,涉及16个省份的193家企业;进口创新医疗器械43个,涉及6个国家的24个企业。北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量较多,约占全部已批准的315个创新医疗器械的75.9%,与2023年相比有所下降。
已批准的创新医疗器械中,有源产品占比约61%,无源产品约31%,体外诊断试剂产品约8%。
2024年,国家药监局共批准65个创新医疗器械产品上市,相比2023年增加6.6%。
其中,有源医疗器械45个、无源医疗器械17个、体外诊断试剂3个。
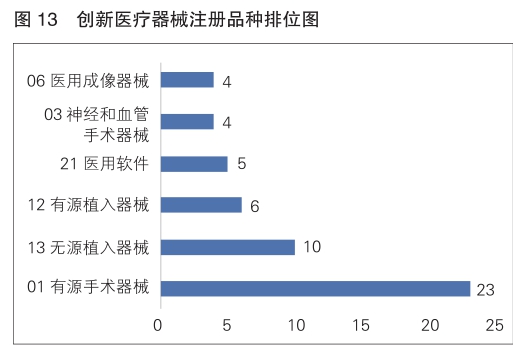
有源手术器械、无源植入器械、有源植入器械、医用软件、神经和血管手术器械以及医用成像器械等高端医疗器械是2024年批准的创新医疗器械中数量前五位的品类,与2023年相比,神经和血管手术器械、有源植入器械增加较快。具体见图13。
五、其他注册管理情况
(一)境内第二类医疗器械注册审批情况
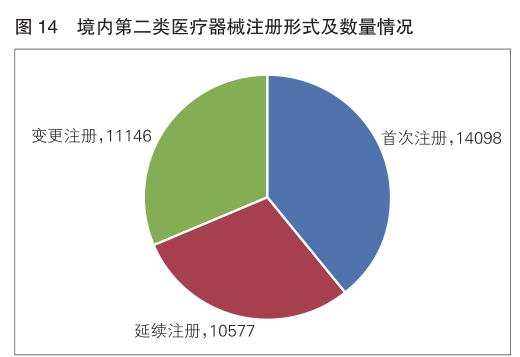
2024年,各省级药品监管部门共批准境内第二类医疗器械注册35821项,与2023年相比增加6.7%。其中,首次注册14098项,与2023年相比增加1%,占全部境内第二类医疗器械注册数量的39.4%;延续注册10577项,与2023年相比增加12.1%,占全部境内第二类医疗器械注册数量的29.5%;变更注册11146项,与2023年相比增加9.3%,占全部境内第二类医疗器械注册数量的31.1%。2024年各省(区、市)共注销1423个医疗器械注册证。境内第二类医疗器械注册形式及数量情况见图14。
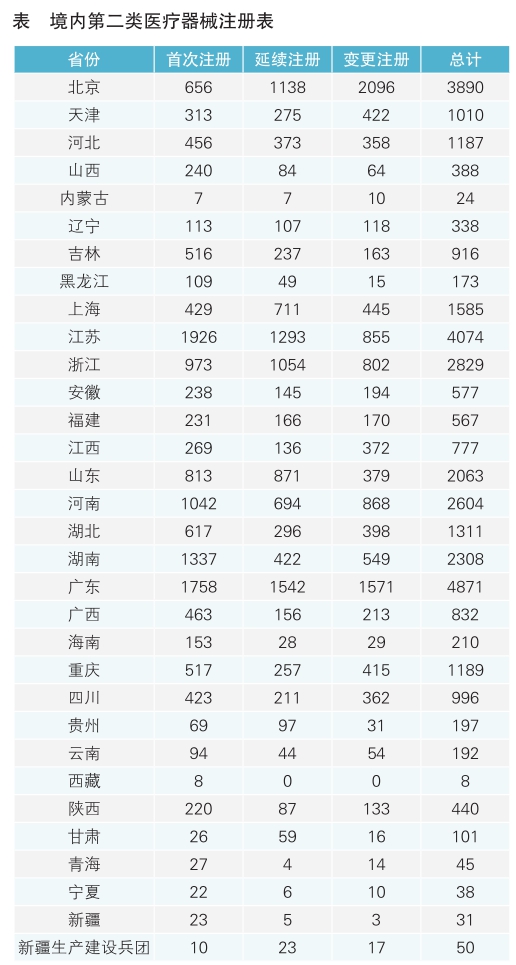
从注册情况看,广东、江苏、北京、浙江、河南、湖南、山东、重庆、上海、湖北10省(直辖市)办理境内第二类医疗器械注册事项较多。
第二类医疗器械注册具体数据见表。
从首次注册情况看,江苏、广东、湖南、河南、浙江、山东、北京、湖北、重庆、吉林10省(直辖市)首次注册的境内第二类医疗器械数量较多。
(二)第一类医疗器械备案情况
2024年,国家药监局依职责共办理进口第一类医疗器械备案数量2151项,与2023年相比减少12.3%。
2024年,全国设区的市级药品监管部门依职责共办理境内第一类医疗器械备案数量22855项,与2023年相比减少11%,已连续两年减少。其中,江苏、广东、浙江、山东、河南是第一类备案数量前五的省份。此外,2024年各省份共取消第一类医疗器械备案13342项。
(三)登记事项变更/变更备案情况
2024年,国家药监局依职责共办理进口第二、三类和境内第三类医疗器械变更备案9852项,与2023年相比增加55.1%。
其中,境内第三类医疗器械变更备案7036项,进口第二类、三类医疗器械变更备案2816项。
各省级药品监管部门依职责共办理境内第二类医疗器械变更备案19347项,与2023年相比增加24.2%。
(四)医疗器械临床试验机构备案情况
自2018年1月1日《医疗器械临床试验机构条件和备案管理办法》颁布实施以来,全国共计1498个机构完成了医疗器械临床试验机构备案工作,2024年新增备案机构158个,比2023年增加11.8%。
其中,广东、江苏、山东、浙江、河南临床试验机构备案数量居全国前五名。
注:本报告的数据统计自2024年1月1日至2024年12月31日。 (报告来源:国家药监局网站)