□ 吴琼文倩
2023年对于我国罕见病患者而言是意义重大的一年,一系列利好政策大力推进了罕见病药物审评审批加速,缩短了罕见病患者治疗等待时间,提升了患者生活质量,更是对创新药企和投资机构加强罕见病药物研发的鼓励。
然而也要看到的是,推进我国罕见病药物研发、用药可及和保障仍有很长的路要走,需要从顶层设计到基层落实共同发力。
获批药物数量激增
罕见病虽然单病种患病率低,但在我国庞大的人口基数面前,并不“罕见”。截至2023年9月,国家罕见病直报系统已收集78万个罕见病病例。目前,全球罕见病数量达7000多种,占人类疾病数量的10%,我国已发现的罕见病为1423种,第一批、第二批罕见病目录共收录207种。为了让更多罕见病患者有药可治,在研发、审批、使用的全链条中,需要从政策、市场、产业等多方面推进。
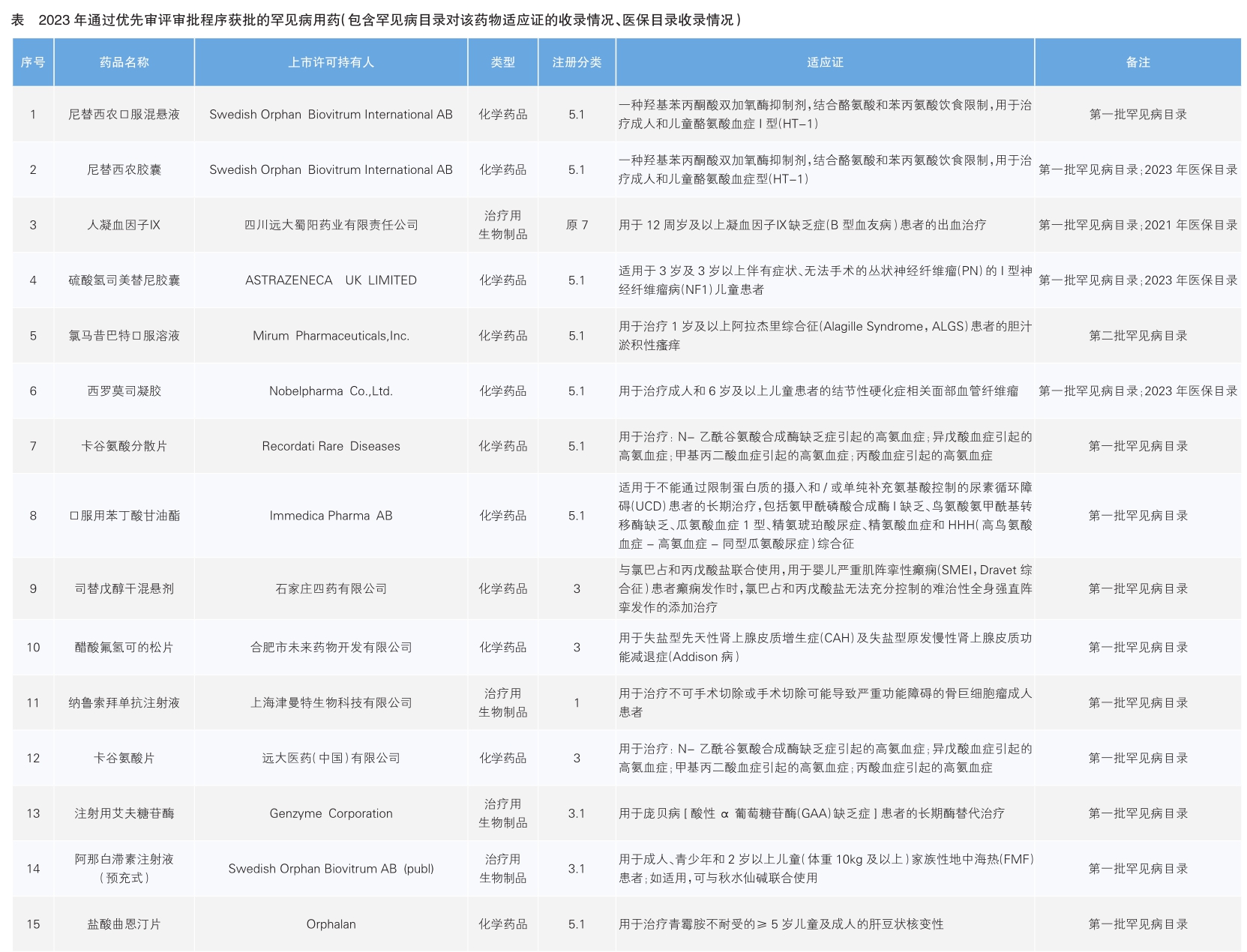
《2023年度药品审评报告》显示,2023年国家药品监管部门共批准罕见病用药45个品种(未包括化药4类罕见病用药),罕见病用药审评工作取得积极成效。从覆盖病种及相应临床需求的满足来看,获批药物涉及血液、神经、代谢、免疫、罕见肿瘤等多个领域,填补了我国多项临床治疗空白。如2023年4月获批上市的硫酸氢司美替尼胶囊,是首个获批的Ⅰ型神经纤维瘤病(NF1)相关丛状神经纤维瘤(PN)治疗药物;2023年6月和9月分别获批上市的卡谷氨酸分散片原研药及仿制药,用于N-乙酰谷氨酸合成酶缺乏症(NAGSD)、丙酸血症(PA)、甲基丙二酸血症(MMA)和异戊酸血症(IVA)引起的高氨血症的治疗,填补了我国该类疾病领域的治疗空白。
从审评路径上看,共有15个品种(33.3%)通过优先审评审批程序得以加快上市,其中进口品种8个,其余7个由国内药企研发。原研创新药纳鲁索拜单抗注射液(商品名:津立生)通过优先审评审批程序附条件批准上市,是全球首个IgG4 RANKL抑制剂,用于治疗不可手术切除或手术切除可能导致严重功能障碍的骨巨细胞瘤成人患者,与原有治疗药物开展头对头研究显示具有显著临床优势,是2023年我国国产罕见病原研药的一大亮点。
政策发力是加速罕见病药物审评审批的重要支撑。2023年,相关部门出台了一系列政策推动罕见病药物上市:3月,国家药监局药品审评中心(CDE)发布《加快创新药上市许可申请审评工作规范(试行)》,工作规范适用于儿童专用创新药、用于治疗罕见病的创新药以及纳入突破性治疗药物程序的创新药,范围不再仅局限于罕见病目录中病种的治疗药物;7月,CDE发布《罕见疾病药物开发中疾病自然史研究指导原则》,从临床实际角度出发,从发病率/患病率角度对罕见病进行定义,实现了罕见病药物审批加速的重大突破。
此外,CDE与中国食品药品国际交流中心在2023年的第16个国际罕见病日,共同组织召开了“以患者为核心的罕见疾病药物研发”研究课题调研会,旨在让罕见病患者可以全程参与药物研发,发挥患者观点对药物研发的指导作用。
多手段拓宽境外引入
长期以来,部分罕见病药物“境外有药,境内无药”的问题困扰着相当一部分罕见病患者。2020年CDE发布的《境外已上市境内未上市药品临床技术要求》明确,经评估安全有效且无种族敏感性的境外已上市药品,可豁免境内临床试验直接在中国批准上市,从而鼓励罕见病药物的引入,解决我国罕见病患者的临床迫切需求。
海南博鳌乐城国际医疗旅游先行区试点、“港澳药械通”和北京天竺罕见病药品保障先行区等新药准入“快车道”,是境外药品进入我国先行先试的路径。
在博鳌乐城,相关药品进行备案后可直接投入使用,产生的真实世界数据可用于支持后续产品注册申报或上市后承诺性研究。2023年6月,再鼎医药艾加莫德α注射液基于真实世界研究结果获批上市,成为全球首个具有高级别循证医学证据支持并获得阳性结果的FcRn拮抗剂,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力患者。2023年6月,琅铧医药盐酸替洛利生片基于真实世界研究结果获批上市,成为我国唯一获批的发作性睡病治疗药物。目前,这两种药物都已被纳入2023年版国家医保药品目录。
通过“港澳药械通”,经广东省药监局核准,港澳上市的创新产品可以进入大湾区指定医疗机构使用。目前已引进救治庞贝病和难治性癫痫等药物,填补了区域内罕见病用药空白。
2023年11月,《支持北京深化国家服务业扩大开放综合示范区建设工作方案》获批,在此方案指导下,罕见病患者可以通过北京天竺保税区获得境内未注册上市的罕见病药物。
进一步完善罕见病保障机制
近年来,一系列促进罕见病药物审批、使用政策的发布和落地,极大地保障了罕见病患者的用药和治疗需求,鼓励了我国罕见病药物的研发。然而,无论是在全球范围内还是在我国,罕见病领域仍有大量未被满足的临床需求。根据哥本哈根经济研究所的研究数据,目前全世界范围内只有约5%的罕见病患者有获得授权的治疗方法。因此,无论从提升人民健康水平,还是进一步推进医药创新产业发展的角度,畅通罕见病药物研发、引进、审批以及入院路径,每一步都有着极为重要的意义。
首先,聚焦科技创新,建立罕见病药物的全链条临床研究合作平台,找准需求、科学布局极为重要。2023年北京协和医院院长张抒扬在Nature子刊上发表的关于罕见病药物研发趋势的文章显示,在全球范围内生物制剂几乎占罕见病药物研发管线的一半(49%),特别是核酸药物、细胞基因治疗等领域,可能成为未来我国罕见病药物研发的增长点。此外,她在当选中国医药创新促进会2024年度会长时也表示,未来将坚持“创新、协同、持续”理念,临床研究工作将从被动服务到主动孵育,为推动创新药械加快上市提供政策依据,打造创新成果转化生态圈。
纵观全球,欧洲对罕见病药物研发进行了专门立法,还通过“政府+社会”建立的基础研究资金伙伴关系和研发、监管、资本三方的早期证据伙伴关系,确保药物研发符合患者需求和市场期望,这对于我国具有重要的借鉴意义。目前,我国科技及药品监管等相关部门也在积极推进相关试点行动,鼓励和推进临床急需等罕见病用药研发以及高质量创新。
其次,当前罕见病药物从监管准入到患者使用,仍存在堵点。根据国家医保局的最新数据,叠加其他药品准入方式,目前我国获批上市的75种罕见病药物中已有50余种纳入医保药品目录。然而,部分罕见病药品虽然被列入了医保目录,却出现难以进入医院、医生不愿处方、地方医保的报销制度不落地等问题,导致患者依然难以获得处方和报销。因此,当前仍需尽快探索和完善罕见病药物的准入、价值评估方法、支付方式,充分调动各项罕见病保障机制的作用。
利好政策密集出台,部分罕见病已经实现了“有药可医”,然而想要罕见病患者“用得起药”以及“能长期用药”,亟需多方携手推进罕见病的多层次保障体系和综合救助体系建设。例如,梳理和总结地方已试行的罕见病用药专项基金、医疗救助、商业健康险等多元筹资和共付的成熟经验,以探索形成国家基本医保、商业保险多层次保障制度有效衔接,为减轻罕见病患者疾病负担保驾护航。
此外,如何确定适宜的罕见病定义,仍需进一步探索逐步突破罕见病目录的限制。目前,仍有大量罕见病目录以外的罕见病患者无法享受相关药物加快审评审批使用及支付等优惠激励政策,不利于实现公平性和保障患者健康权。因此,建议逐步探索基于罕见病发病率、遗传特性、疾病严重程度等因素确定更为适宜的罕见病定义,建立罕见病注册和监测系统以及动态更新机制,并加强卫生健康、科技、教育、医保等多个部门合作,全链条推动对罕见病的关注和重视,共同参与罕见病药物研发和使用,确保政策的全面性和协调性。
我国罕见病患者数量大,患者需求呈现多样化、复杂化,更需要精准高效的政策激励。可喜的是,一批批医药创新企业正在克服各种困难,积极推进罕见病领域布局,关注未被满足的患者需求,提高早期研发水平,部分罕见病药物临床试验已经实现国际同步或全球领先。长期稳定的政策激励将会进一步推动我国罕见病药物研发,填补当前罕见病的临床空白,实现人民健康水平全方位、全周期的提升。
(作者单位:中国医药创新促进会政策研究中心)