□ 袁盛 朱鹏志
随着脑机接口(BCI)技术的发展,其内涵和外延也在不断丰富。广义的BCI包含输出式BCI和输入式BCI。输出式BCI主要由大脑向外部设备输出通信或控制指令,并把结果通过神经反馈给用户形成闭环以调节其脑活动信号,从而提升脑机交互的性能;输入式BCI主要由外部设备或机器绕过外周神经或肌肉系统直接向大脑输入电、磁、声、光等的刺激或神经反馈,以调控中枢神经活动。
产品注册上市情况
美国Neurolutions公司的IpsiHand上肢康复系统于2021年4月成为首个获得美国食品药品管理局(FDA)批准上市的用于帮助患者康复的非侵入式BCI机器人,该系统由脑电头套、机器人外骨骼和平板电脑组成,能够通过检测大脑未受损部分电信号,控制佩戴在患者患侧手上的外骨骼,从而改善患者的抓握能力。该产品的类别为脑电图(EEG)驱动的上肢动力锻炼器,属于Ⅱ类医疗器械。
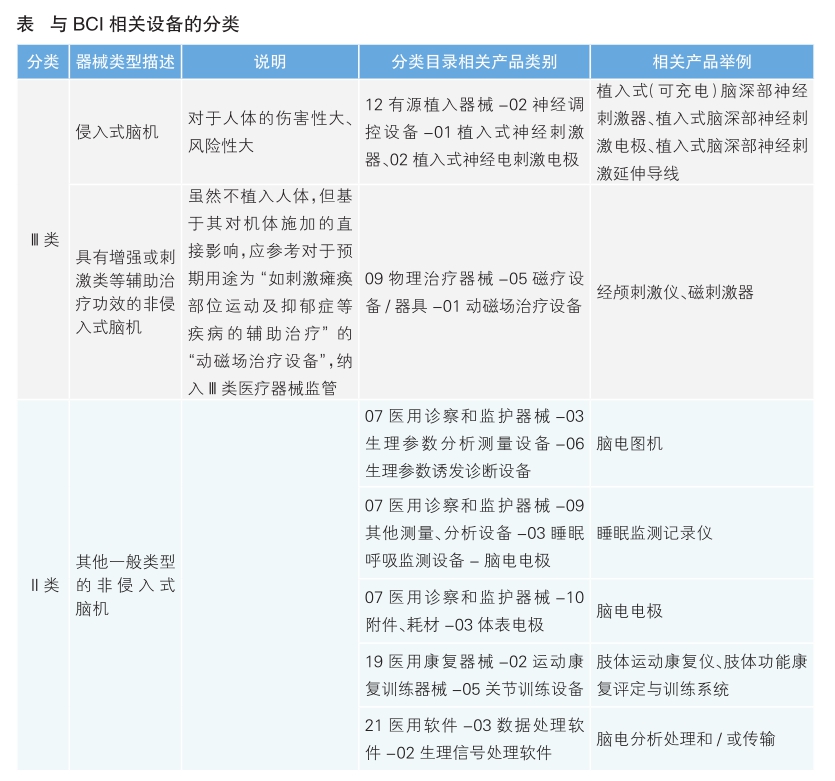
根据广义BCI定义,结合我国现行《医疗器械分类目录》的规定,与BCI相关设备的分类主要为Ⅱ类和Ⅲ类(详见表)。
由于Ⅲ类医疗器械在注册难度、监管要求、申请受理部门层级和申请时长等方面都远高于Ⅱ类医疗器械,我国BCI产品研发生产企业目前大多选择非侵入式采集技术路线。对于侵入式脑机设备的研发,目前都处在临床前研究和动物实验阶段,暂无获批进入人体临床试验阶段的产品。
BCI产品临床试验研究
2021年7月,美国Synchron公司研制出基于神经介入技术的传感器,可通过血管传输到大脑,进而免去开颅手术。该产品获得FDA临床试验医疗器械豁免(IDE),并已招募多位志愿者入组开展临床研究。
FDA在2021年发布《用于瘫痪或截肢患者的植入式脑机接口(BCI)设备的非临床和临床考虑因素——FDA工作人员指南》(以下简称BCI设备指南),对植入式BCI医疗器械在申请IDE或注册上市的预提交阶段提出了可借鉴的一般性建议,主要包括:
●非临床性的建议:提交对于BCI设备及其软件的完整描述、风险管理评估;考虑人为因素、生物相容性、电磁兼容性等;验证整个系统和系统组件之间的兼容性符合特定标准并提供相关科学或临床依据。
●动物实验方面的建议:原则上建议植入式BCI医疗器械首先应通过动物实验评估设备的体内安全性;需要考虑动物实验的结果是否可以为设备的安全性提供证据;实验方案是否已尽可能降低动物负担或避免额外实验;实验行为是否符合良好实验室规范标准等。
●临床试验方面的建议:申请者需要考虑设备的家用性并于临床协议中具体描述如何执行;试验面向的患者群体应根据潜在益处大于风险的原则结合患者需求及风险承受能力考虑;试验的知情同意书及试验计划内容必须具备BCI设备指南要求的要素。
我国监管部门尚未发布类似指南。根据公开报道,我国专家呼吁关注侵入式BCI设备应用于临床试验时的安全与伦理问题,包括但不限于:
●安全问题:植入电极的手术风险和术后感染及排异的风险;在BCI系统可以增强或刺激神经元活动的情况下,应保证不会给神经元及神经系统带来损伤、避免患者产生不当幻觉。
●伦理问题:读取患者的神经活动信息以及潜意识等内容是否构成对其个人隐私的侵犯、是否符合人类道德和社会伦理规范;在BCI系统可以稳定增强或刺激神经元活动的情况下,增强的限度是否会超越自然水平,从而引发社会公平性等隐忧。
此外,还有许多专家呼吁建立BCI技术标准和数据规范等,以促进研究与行业的有序发展。在安全、伦理和标准化等问题均得到有效解决后,BCI技术应用于人体临床试验才更有保障。
BCI技术标准化进展
国际标准化进展
BCI标准化工作已得到国际标准化组织(ISO)、国际电工委员会(IEC)、国际电信联盟(ITU)的广泛重视。电气与电子工程师协会(IEEE)旗下的医学与生物学工程学会(EMBS)已开展数个BCI标准化项目研究。
2021年11月召开的ISO/IEC JTC 1全会上正式通过了我国发起成立SC 43脑机接口分技术委员会的提案。脑机接口分技术委员会的成立,说明该技术如同人工智能技术一样具有颠覆性和独特性,单独设立面向BCI技术的ISO/ IEC JTC 1/SC 43,将有效助推本领域的国际标准化工作。全会同时通过了《信息技术 脑机接口 用例》的立项提案,将与2021年10月立项的ISO/IEC AWI 8663《信息技术 脑机接口 术语》标准一并在ISO/IEC JTC 1/SC 43的指导下开展工作。
国内标准化进展
在BCI领域,我国学术界和产业界密切互动,促进先进技术走出实验室,实现产业化,同时也推动和促进了我国BCI标准化进程。
早在2013年,中国电子技术标准化研究院和浙江大学共同推动在全国信息技术标准化技术委员会用户界面分技术委员会(SC 35)下设脑机交互研究组。2019年,我国专家牵头撰写的BCI标准化研究报告于ISO/IEC JTC 1上发布,推动成立了ISO/IEC JTC 1/AG 16脑机接口咨询组,提交了Study Reportfor BCI,同期开展了术语标准提案研究和脑机接口用例研究,不仅填补了ISO、IEC在BCI国际标准化工作的空白,还成功牵头立项首个BCI国际标准(ISO/ IEC AWI 8663)和用例报告,推动在ISO/IEC JTC 1下新设脑机接口分技术委员会。
在紧密推动脑机接口国际标准化工作的同时,脑机接口的术语、参考架构、安全伦理等标准被列入2022年国家重点标准立项建议,相关国家标准制定工作稳步进行,国际国内标准化研究项目密切联动。
2021年7月,中国电子技术标准化研究院牵头与多家高校和科研院所共同发布了本领域首部标准化白皮书《脑机接口标准化白皮书(2021版)》;中国人工智能产业发展联盟发布《脑机接口技术在医疗健康领域应用白皮书》。2021年10月,中国信息通信研究院发布《脑机接口技术创新与产业发展研究报告(2021年)》。
上述研究成果系统性地梳理了BCI领域的技术发展趋势和示范性应用,阐述了标准化需求和挑战,为产业链、创新链、标准链“三链融合”夯实基础。
技术研发与监管建议
调整当前临床审批对BCI技术的适用性 Ⅲ类医疗器械审批受到药监部门的严格监管,并且由有资质的医院完成确诊和植入以确保安全性。基于现有研究进展,与运动功能相关的BCI产品对肢体瘫痪患者有较明显的帮助,而与精神类疾病相关的应用场景由于病因病理研究不完善,靶点难以确定,仍需要进一步探索。为促进相关研究领域的发展,建议适当调整当前临床试验审批对于侵入式BCI产品的适用性。
建立BCI系统的科学评价标准和伦理标准 随着技术不断进步,需推动制定政策指引并建立统一的评价标准体系,进一步强化标准引领机制,完善监管制度,重视安全和伦理问题,保障BCI技术在研发、使用和普及过程中重要环节的安全有效,以标准化护航BCI产业健康快速发展。
关注BCI医疗器械特殊审批 基于BCI技术的临床应用价值及前沿性,企业可能考虑按照相关标准申请创新医疗器械审批,在满足相应条件的情况下推进产品尽快上市。此外,BCI技术目前已知的一些重要临床应用场景涉及众多尚无有效诊断或治疗手段的罕见病、老年病,企业也可能按照自身产品情况或其预期用途判断提出优先审批申请,监管部门应给予关注。
(作者单位:国家药监局医疗器械技术审评检查长三角分中心)