日前,中国食品药品检定研究院(以下简称中检院)发布了《中国食品药品检定研究院2022年度科技报告》(以下简称《报告》)。
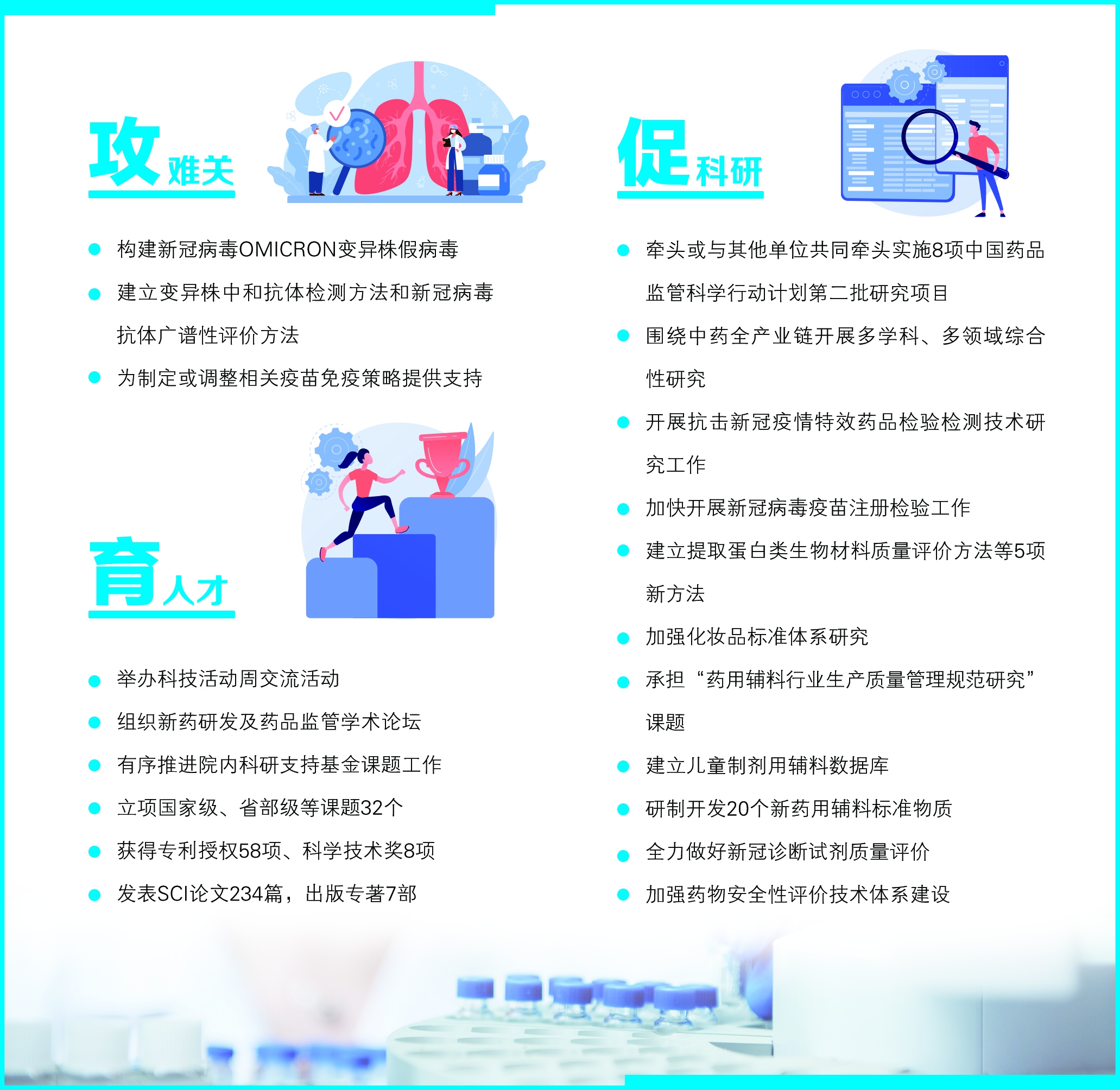
《报告》显示,2022年,中检院统筹做好抓检验、保安全、促发展各项工作,坚决扛起疫情防控政治责任,全力以赴做好抗击新冠疫情产品相关检验和科研工作,服务疫情防控大局取得新成绩,科研工作取得新成效,为药品监管治理体系和治理能力现代化建设提供有力的技术支撑,为群众用药安全有效提供坚实的技术保障。
持续开展疫苗等疫情防控用药械科研攻关
2022年,中检院密切跟踪新冠病毒变异株的发生,构建了新冠病毒Omi cr on变异株假病毒,建立变异株中和抗体检测方法和新冠病毒抗体广谱性评价方法,为新冠疫苗免疫血清中和抗体效价等评价提供方法和假病毒,支持新冠疫苗序贯免疫策略评价和现有疫苗免疫血清对变异株中和效果的评价工作。根据国务院联防联控机制科研攻关组疫苗研发专班和国家药监局要求开展研究,为国务院联防联控机制和疾控部门制定或调整相关疫苗免疫策略提供支持。
发挥检验检测能力建设带头作用
开展监管科学行动计划第二批项目研究
在中国药品监管科学行动计划第二批研究项目中,中检院牵头或与其他单位共同牵头实施“化妆品新原料技术指南研究和化妆品安全监测与分析预警方法研究”“新发突发传染病诊断及治疗产品评价研究”“中药有效性安全性评价及全过程质量控制研究”“基于远程传输、柔性电子技术及医用机器人的创新医疗器械评价研究”“新型生物材料安全性有效性评价研究”等8个项目,均在有序稳步推进中。
检验检测技术支撑能力不断增强
中药领域
在中药质量安全领域,中检院围绕全产业链开展多学科、多领域综合性研究。建立多项中药质量检定新技术、新方法、新标准。开展中药DNA分子鉴定方法的标准提升和推广应用工作,建立TaqMan探针荧光定量PCR技术中药掺伪检测平台,起草多项国家标准,为中药掺伪打假提供有力的技术支撑。开展中药内源性有毒有害成分和中药外源性有害残留物检测、限量标准与风险评估研究。2022年,组织实施的30个含细辛中成药和10个含马兜铃属药材的中成药标准提高课题正式立项。开展基于人工智能、AR/VR和知识图谱等技术的中药数字化标本研究,完成果实类药材专题71种药材研究,起草中药材标本数字化规范。开展民族药质量安全检测与标准技术研究,组织专家对国家药监局药品注册司民族药示范研究二期项目进行结题评审,并启动三期项目。
化药领域
开展抗击新冠疫情特效药品检验检测技术研究工作。建立完善抗疫药品应急检验响应机制,做好注册检验前期技术储备;密切关注新冠肺炎防治药品研发进展,重点关注国内外新冠肺炎防治化学药物,以最短时间完成瑞德西韦、阿比多尔、普克鲁胺、阿兹夫定、Paxl ovid等重点品种前置注册检验工作;密切追踪药物基因毒性杂质最新研究情况,开展遗传毒性杂质检测方法与策略研究;积极追踪国外事态进展,组织开展风险研判。
研究建立沙坦类药物、雷尼替丁类药物、二甲双胍类、利福平类、降糖类等药品中亚硝胺类化合物分析方法。开展药品中N-亚硝胺类基因毒性杂质控制策略研究,积极开展相关标准物质的研制工作,指导各省级药品检验机构进行相关检测工作,为国家药监局组织重大问题处理提供技术支撑。
持续开展国家药品标准方法研究。重点加大临床急需药品标准的研究力度,开展放射性药品锝[99mTc]二巯丁二酸盐注射液质量标准提高研究、抗生素发酵残留物检测新技术研究以及化学计量学指导原则建立、溶出度与释放度测定法往复支架法建立研究等国家药品标准提高等课题13项。
生物制品领域
2022年,中检院加快开展新冠病毒疫苗注册检验工作,有力推动相关产品研发和应用,同时积极做好新冠病毒疫苗保质量保供应工作。中检院统筹协调全国18家药检机构,共同开展新冠病毒疫苗批签发和第三方检验工作;密切跟踪新冠病毒Omicron BA和BQ系列变异株等,完善新冠病毒广谱性中和抗体评价假病毒库,建立变异株中和抗体检测方法和新冠病毒抗体广谱性评价方法,支持新冠病毒疫苗序贯免疫策略评价和现有疫苗免疫血清对变异株中和效果的评价工作;建立第二代新冠病毒中和抗体国家标准品,并对新冠病毒活病毒中和抗体检测方法进行标准化研究,提高新冠中和抗体检测结果的可靠性,实现不同技术路线新冠病毒疫苗中和抗体检测结果的稳健可比;利用治疗性生物制品质量控制技术平台,对疫情防控所用的治疗性抗体、特异人免疫球蛋白、疫苗生产用细胞基质等产品进行应急检验和评价,有力支持相关产品研发和上市;持续开发传统疫苗效力试验替代方法等质量控制新方法,提升检验效率和检验能力。
此外,中检院还建立基于Luminex技术的多联多价疫苗中各个组分抗原与抗体检测新方法,显著加快新型联合疫苗的临床效果评价工作;应用LC-MS质谱技术,对破伤风、白喉类毒素的脱毒后抗原进行脱毒位点确认,用于残余毒性的质量控制,并为提升批间一致性提供新工具。
医疗器械领域
2022年,中检院建立了脑部植入实验、变性胶原蛋白检测-胰蛋白酶敏感性实验、医疗器械致癌性筛查-体外细胞转化试验和提取蛋白类(胶原蛋白、丝素蛋白)生物材料的质量评价方法等5项新方法;完成主动脉瓣膜及二尖瓣膜的PIV流场测试用模块的设计及加工;完成人工血管顺应性测试方法研究的动态顺应性测试和数据采集;开展7项新工具研究,其中内窥镜检测工装升级上市,医用机器人性能检测工装研制成功,介入式人工心测试平台、腔镜畸变延时检测平台、相机色还原性检测平台、声阻抗仪测量、气源管路高压检验平台研究顺利推进。
化妆品领域
2022年,中检院加强化妆品标准体系研究,协助筹建化妆品技术规范委员会;持续完善技术标准体系,已完成27项化妆品、化妆品新原料及毒理学试验等相关技术指导原则(草稿)的制定工作,部分指导原则已经应用于化妆品及新原料的技术审评实践中,用以规范相关技术审评工作;持续优化完善“化妆品智慧申报审评系统”,积极开展第二批智慧审评功能建设,以智慧化手段进一步提高审评效率和审评质量。同时,对“化妆品原料安全信息登记平台”进行持续优化和数据利用,该平台现已完成超过22万个原料信息的收集,为我国化妆品监管和安全技术评价提供了强有力的大数据支撑。
辅料包材领域
2022年,中检院承担国家药监局食品药品审核查验中心“药用辅料行业生产质量管理规范研究”课题,服务药用辅料GMP修订;作为主编单位撰写“药剂学前沿丛书”之一《药品包装材料》,为行业提供最新技术前沿资料;建立儿童制剂用辅料数据库,填补我国儿童制剂相关领域空白;继续完善仿制药质量和疗效一致性评价药用辅料功能性指标数据库,强化仿制药常用辅料质量监督;建立新辅料二硬脂酰磷脂酰甘油钠质量标准,服务高端制剂研发;完成12个药用玻璃中国药典方法标准的起草,服务行业规范发展;研制开发“卡脖子”辅料总计20个新药用辅料标准物质,包括合成磷脂系列、聚维酮系列、脂肪酸酯系列和聚山梨酯系列,有力保障了中国药典及其增补本的顺利实施。此外,还建立了全院生物安全类设备质量分析报告系统,推动全院生物安全类设备检测报告数字化管理;开拓性设计洁净环境领域能力验证活动,首批能力验证活动(风速、悬浮粒子和照度)成功实施,促进洁净环境行业检测技术提升;将“京津冀洁净检测技术联盟”扩容为“中国药监洁净检测技术联盟”(秘书处设在中检院药用辅料和包装材料检定所),积极组织洁净环境标准协调和技术交流,服务行业发展。
体外诊断试剂领域
中检院以疫情防控产品为重点,全力做好新冠诊断试剂质量评价;积极推进承担的中国药品监管科学行动计划第二批重点项目研究,并取得了有效进展;积极开展标准物质研制工作,2021年2月以来,共完成标准物质研制13项;起草的抗人球蛋白检测卡(柱凝集法)等3项行业标准发布;积极推进医用高通量测序标准化技术归口单位有关工作;作为国际标准化组织医用临床检验实验室和体外诊断系统标准化技术委员会第六联合工作组(ISO/TC212/JWG6)中方专家,参与制定多项国际标准。
药品安全评价领域
中检院紧密围绕国家药监局监管需求,紧跟国际先进技术前沿和监管研究理念,进一步加强药物安全性评价技术体系建设,开展前瞻性技术研究。其中,基因和细胞治疗评价、新型抗体和疫苗评价、纳米药物评价、生物分布、生物标志物等多项关键技术研究水平与国际先进水平一致,全面支撑国家药品科学监管。初步建立人体器官芯片技术、3D肝脏细胞模型、神经毒性早期筛选模型、遗传毒性计算机虚拟筛选和预测技术、转基因新模式动物、AI病理诊断技术等;开展30余种创新药物品种的全面安全评价,包括各类CAR-T产品、干细胞产品、肿瘤新抗原、ADC单抗、溶瘤病毒产品等,其中3项药物获得临床试验批件,1项通过国家干细胞临床研究项目备案,推进我国细胞和基因治疗产品等重大创新药物的上市。参与国家药监局首批监管科学研究项目,起草纳米药物、ADCs等国家标准和指导原则,促进药品监管科学体系建立。
多措并举大力培养科技人才
2022年,中检院组织开展了一系列科技交流活动,以增强学术氛围,提升科研人员能力和水平,并设立专项基金支持科研工作和人才成长。
举办科技活动周交流活动
2022年9月27日至30日,中检院举办科技活动周活动,旨在提升全院科研人员科研能力,促进学术发展,适应监管科学和医药产业发展需求。此次交流活动以监管科学为主线,围绕食品药品监管热点,安排了4个领域分会场的线上和线下活动。
在理化分析领域分会场,来自中国计量科学研究院、武汉工程大学的专家,分别以“标准物质计量溯源性”“核磁共振技术在复杂混合物分析中的应用”作报告;中检院专家围绕中药质量评价、药物新型制剂评价等主题,作题为“板蓝根质量评价创新模式研究”“中药中肝毒性吡咯里西啶生物碱的检测及其风险评估”“基于质谱信息库系统的中药材及饮片智能化‘身份’鉴定方法研究”“核磁共振技术在药品及药品标准物质中的应用”“头孢菌素类抗生素的聚合物研究”“透皮贴剂质量控制研究进展”“复杂制剂效能性质量指标的控制探讨”“流变学在药用辅料及药品质量控制方面应用”“注射剂包装容器密封完整性评估技术研究”“纳米技术化妆品安全评价研究”“保健食品中藻类毒素检测”的报告。
在生物领域分会场,来自空军军医大学、复旦大学的专家,分别以“新冠病毒新型受体的研究”“广谱冠状病毒疫苗的研发”为题,分享相关领域研究进展;中检院生物制品、实验动物、食品检定和诊断试剂领域的专家,以“ADC药物研发进展”“干细胞研究进展”“结核防治产品研究进展”“传染性疾病动物模型的研究进展”“多杂质大样本量液体中沙门氏菌的检测”“病原体宏基因组测序方法的评价”为题作报告。
在药理毒理领域分会场,中检院组织开展化妆品动物试验替代方法研究成果示范活动,旨在提高我国化妆品安全评价技术水平,促进“3R”动物替代理念在化妆品领域推广和动物试验替代方法示范,加强全国药检系统化妆品替代毒理技术培训。来自东南大学、中国疾病预防控制中心、浙江省食品药品检验研究院的专家,分别以“人体器官芯片在药物和化妆品筛选评价及精准医学中的研究和应用”“动物替代试验在化妆品原料安全评价中的应用”“我国化妆品功效评价的现状和思考”为题作报告;中检院专家分别围绕“创新技术化妆品新原料安全评价研究”“三维皮肤模型用于皮肤刺激及纳米材料透皮性研究”“方法转移和替代的统计比较规范研究”“三维培养模型用于遗传毒性替代研究进展”“化妆品安全评价最新进展”“替代新技术新方法在药品安全性评价中的应用”等主题作交流。
在医疗器械领域分会场,中检院的11位专家分别汇报了近一年来在各自领域所做的研究工作。他们分别以“国家标准品量值溯源和生化标准品赋值研究”“新型冠状病毒中和抗体检测的标准化——体外替代方法探讨”“丙肝诊断的标准及标准物质”“数字疗法产品质量评价探讨”“穿戴式电声设备质量评价方法研究”“持续葡萄糖监测系统(CGM)质量评价方法的研究”“血液透析器的生物安全性研究”为题,围绕医疗器械质量评价、检验检测平台建设和技术创新等热点作报告。
此次交流活动按照疫情防控要求未安排主会场活动,4个分会场交流由中检院学术委员会各分委会主办,采取线上线下相结合的方式举办。来自全国药检系统、高校、科研院所及相关企业等400余家单位的代表参与交流。
(下转7版)