
第一章 药品注册申请受理情况
(一)总体情况
1.全年受理情况
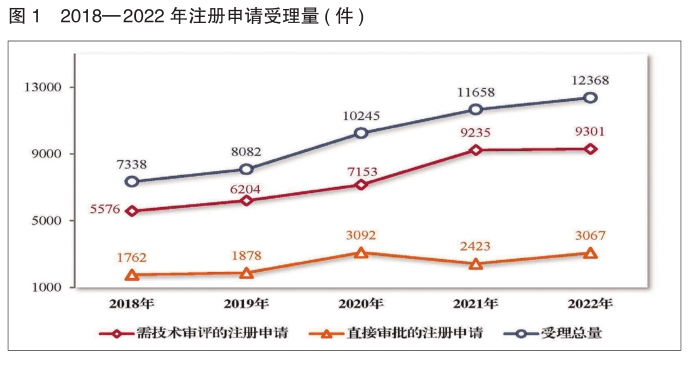
2022年,国家药监局药品审评中心(以下简称药审中心)受理注册申请12368件 ,同比增加6.09%。
受理需技术审评的注册申请9301件,同比增加0.71%,包括需经技术审评后报送国家药监局审批(以下简称技术审评)的注册申请2651件,需经技术审评后以国家药监局名义作出行政审批(以下简称审评审批)的注册申请6644件,需经技术审评后送国家药监局医疗器械技术审评中心、以医疗器械作用为主的药械组合(以下简称药械组合)注册申请6件。
受理无需技术审评直接以国家药监局名义作出行政审批 (以下简称直接审批)的注册申请3067件,同比增加26.58%。
根据《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告》要求,2022年受理原料药注册申请1253件,同比减少4.57%。
2.需技术审评的各类注册申请受理情况
2022年受理的需技术审评的9301件注册申请中,以药品类型统计,中药注册申请421件,同比减少5.18%;化学药品注册申请7054件,同比增加3.92%,占全部需技术审评的注册申请受理量的75.84%;生物制品注册申请1820件,同比减少8.95%;药械组合注册申请6件。
以注册申请类别统计,受理新药临床试验申请(以下简称IND)2244件,同比减少6.97%;新药上市许可申请(以下简称NDA)334件,同比减少14.14%;同名同方药、化学仿制药上市许可申请(以下简称ANDA)2317件,同比增加29.37%;仿制药质量和疗效一致性评价注册申请 (以下简称一致性评价申请)835件,同比减少8.04%;补充申请3020件,同比减少8.01%。
(二)创新药和改良型新药注册申请受理情况
1.创新药注册申请受理情况
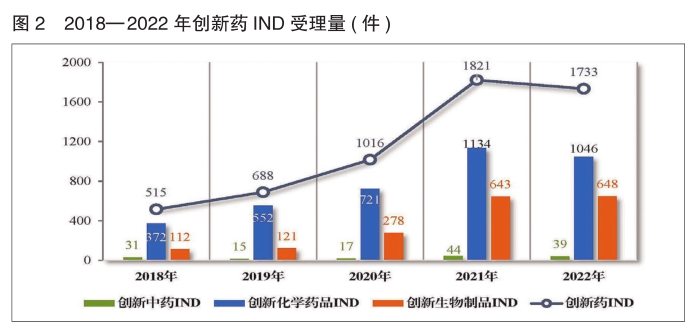
2022年受理创新药注册申请1794件(1010个品种),同比减少4.88%。
以药品类型统计,创新中药49件(46个品种),同比减少9.26%;创新化学药品1075件(481个品种),同比减少7.80%;创新生物制品670件(483个品种),同比增加0.60%。
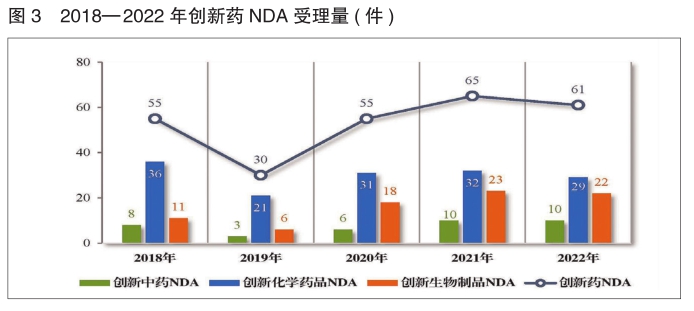
以注册申请类别统计,创新药IND 1733件(969个品种),同比减少4.83%;创新药NDA 61件(41个品种),同比减少6.15%。
以生产场地类别统计,境内生产创新药1432件(817个品种),境外生产创新药362件(193个品种)。
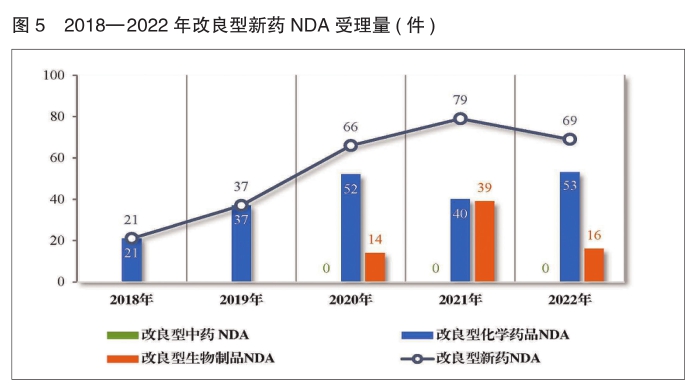
2.改良型新药注册申请受理情况
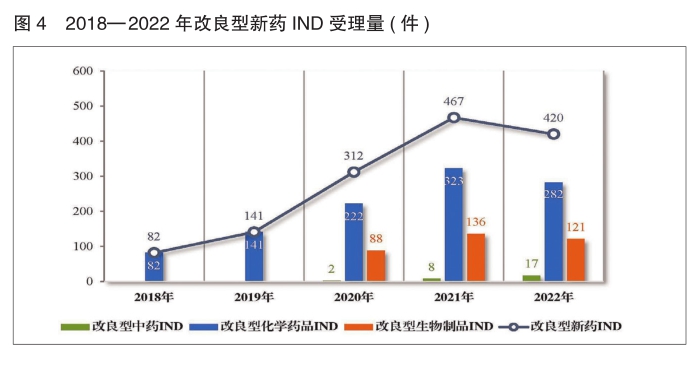
2022年受理改良型新药注册申请489件(292个品种),同比减少10.44%。
以药品类型统计,改良型中药17件(17个品种),同比增加112.5%;改良型化学药品335件(202个品种),同比减少7.71%;改良型生物制品137件(73个品种),同比减少21.71%。
以注册申请类别统计,改良型新药IND 420件(247个品种),同比减少10.06%;改良型新药NDA 69件(45个品种),同比减少12.66%。
(三)需技术审评的中药注册申请受理情况
2022年受理需技术审评的中药注册申请421件。以注册申请类别统计,IND 57件,同比增加9.62%;NDA 14件,与上年持平;ANDA 2件。
以注册分类统计,IND 57件,包括创新中药IND 39件(37个品种),同比减少11.36%;改良型中药IND 17件(17个品种),同比增加112.5%;其他情形1件(1个品种)。NDA 14件,包括创新中药NDA 10件(9个品种),与上年持平;古代经典名方中药复方制剂NDA 4件(3个品种),同比增加33.33%。
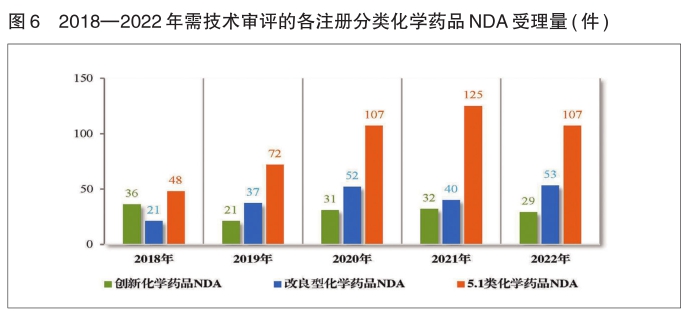
(四)需技术审评的化学药品注册申请受理情况
2022年受理需技术审评的化学药品注册申请7054件。以注册申请类别统计,IND 1328件,同比减少11.47%;NDA 189件,同比减少4.06%;ANDA 2315件,同比增加29.26%;一致性评价申请835件,同比减少8.04%。5.1类化学药品注册申请146件,同比减少13.61%,其中临床试验申请 共39件,NDA 107件。
以注册分类统计,IND 1328件,包括创新化学药品IND 1046件(465个品种),同比减少7.76%;改良型化学药品IND 282件(168个品种),同比减少12.69%。NDA 189件,包括创新化学药品NDA 29件(16个品种),同比减少9.38%;改良型化学药品NDA 53件(34个品种),同比增加32.50%;5.1类化学药品NDA 107件(63个品种),同比减少14.40%。
需技术审评的创新化学药品注册申请共1075件(481个品种) 中,以生产场地类别统计,境内生产创新化学药品841件(371个品种),境外生产创新化学药品234件(110个品种)。
(五)需技术审评的生物制品注册申请受理情况
2022年受理需技术审评的生物制品注册申请1820件,其中,预防用生物制品注册申请161件、治疗用生物制品注册申请1654件和体外诊断试剂5件。
以注册申请类别统计,IND 859件,同比减少0.12%;NDA 131件,同比减少26.40%;补充申请767件,同比减少16.27%;境外生产药品再注册申请63件,同比增加40.00%。
以注册分类统计,预防用生物制品IND 49件,包括创新预防用生物制品IND 21件(17个品种),同比减少19.23%;改良型预防用生物制品IND 16件(10个品种),同比增加433.33%;境内或境外已上市预防用生物制品IND 12件(10个品种),同比减少25.00%。预防用生物制品NDA 15件,包括创新预防用生物制品NDA 3件(2个品种),同比减少40.00%;境内或境外已上市预防用生物制品NDA 12件(7个品种),同比增加50.00%。
治疗用生物制品I ND 810件,包括创新治疗用生物制品I ND 627件(450个品种),同比增加1.62%;改良型治疗用生物制品IND 105件(51个品种),同比减少21.05%;境内或境外已上市治疗用生物制品I ND 78件(36个品种),同比增加20.00%。治疗用生物制品NDA 116件,包括创新治疗用生物制品NDA 19件(14个品种),同比增加5.56%;改良型治疗用生物制品NDA 16件(11个品种),同比减少51.52%;境内或境外已上市治疗用生物制品NDA 81件(47个品种),同比减少22.86%。
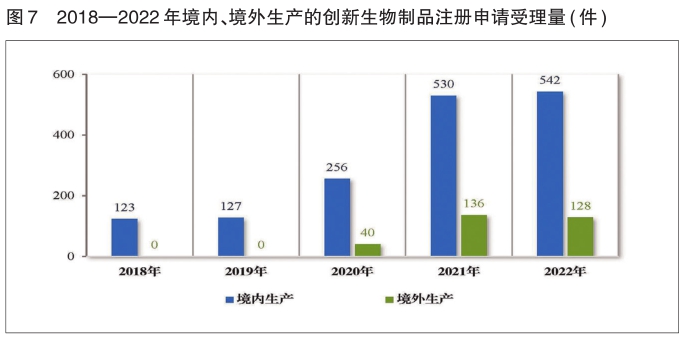
需技术审评的创新生物制品注册申请共670件(483个品种)中,以生产场地类别统计,境内生产创新生物制品注册申请542件(400个品种),境外生产创新生物制品注册申请128件(83个品种)。
(六)行政审批注册申请受理情况
1.总体情况
2022年受理行政审批注册申请9711件,同比增加2.50%。其中,直接审批的注册申请3067件,同比增加26.58%;审评审批的注册申请6644件,同比减少5.77%,包括临床试验申请2372件,同比减少4.47%。
2.审评审批的注册申请受理情况
2022年受理审评审批的注册申请6644件,以药品类型统计,中药注册申请405件,同比减少5.81%;化学药品注册申请4550件,同比减少5.21%,占全部审评审批的注册申请受理量的68.48%;生物制品注册申请1689件,同比减少7.25%。
以注册申请类别统计,临床试验申请2372件,同比减少4.47%;一致性评价申请835件,同比减少8.04%;补充申请3020件,同比减少8.01%;境外生产药品再注册申请417件,同比增加10.61%。
3.直接审批的注册申请受理情况
2022年受理直接审批的注册申请3067件,以药品类型统计,中药注册申请1137件,同比增加22.13%;化学药品注册申请1803件,同比增加30.84%;生物制品注册申请127件,同比增加11.40%。以注册申请类别统计,无需技术审评的补充申请2701件,同比增加34.92%;临时进口注册申请366件,同比减少13.06%。
第二章 药品注册申请审评审批情况
(一)总体情况
近三年新冠疫情对于研发创新的影响愈加明显,国际多中心临床试验受阻,医药研发整体环境不利,申请人无法按时限返回药品注册申请的补充资料,药品审评审批进度也受到影响。为服务申请人,支持药物研发,药审中心积极推动《关于暂行延长药品注册申请补充资料时限的公告》的发布工作并严格落实公告要求,全力确保审评质量效率,但2022年药品注册申请审结总量同比仍有所减少。
1.全年审评审批工作情况
2022年审结的注册申请共11365件,同比减少5.94%。
审结的需技术审评的注册申请8463件,同比减少12.56%,包括技术审评的注册申请1730件,审评审批的注册申请6726件,药械组合注册申请7件。审结直接审批的注册申请2902件。
截至2022年底,有6523件注册申请正在审评审批中;待申请人回复补充资料1457件。2022年审结原料药注册申请835件,同比增加69.03%。截至2022年底,有1774件原料药注册申请正在审评审批中;待申请人回复补充资料581件。
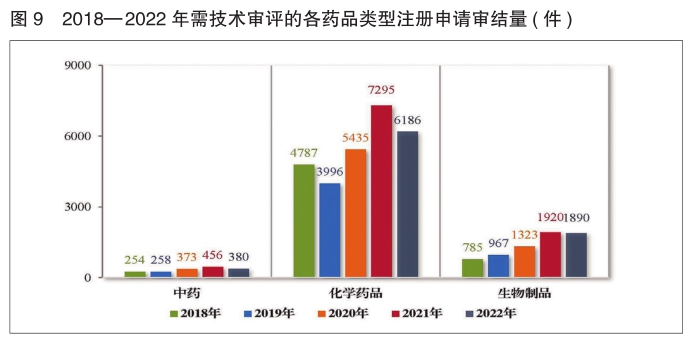
2.需技术审评的各类注册申请审结情况
2022年审结的需技术审评的8463件注册申请中,以药品类型统计,中药注册申请380件,同比减少16.67%;化学药品注册申请6186件,同比减少15.20%,占全部需技术审评审结量的73.09%;生物制品注册申请1890件,同比减少1.56%;药械组合注册申请7件。
以注册申请类别统计,IND 2300件,同比增长1.19%;NDA 337件,同比减少17.40%;ANDA 1394件,同比减少36.92%;一致性评价申请923件,同比减少20.29%;补充申请2950件,同比减少6.32%。
3.批准/建议批准情况
2022年批准IND 2064件,同比减少2.09%;建议批准NDA 269件,同比减少16.72%;建议批准ANDA 1069件,同比增长6.58%;批准一致性评价申请802件,同比减少25.74%。
建议批准境外生产原研药 83个品种(含新增适应证品种)。
临床急需境外新药81个品种中,截至2022年底,已有54个品种提出注册申请,均已获批上市,按审评时限审结率(以下简称按时限审结率)100%。
4.各类别注册申请按时限审结情况
2022年,药审中心持续优化审评流程,严格审评时限管理,加快审评速度,强化项目督导,全年整体按时限审结率99.80%。其中NDA、ANDA、纳入优先审评审批程序的注册申请按时限审结率首次超过98%,取得历史性突破。
(二)创新药和改良型新药注册申请审结情况
1.创新药注册申请审结情况
(1)总体情况
2022年审结创新药注册申请1831件(1036个品种),同比增长4.99%。
以药品类型统计,创新中药52件(49个品种),同比减少5.45%;创新化学药品1113件(513个品种),同比增长2.58%;创新生物制品666件(474个品种),同比增长10.26%。
以注册申请类别统计,创新药IND 1787件(1005个品种),同比增长7.46%;创新药NDA 44件(31个品种),同比减少45.68%。
(2)批准/建议批准情况
2022年批准/建议批准创新药注册申请1649件(947个品种),同比增长1.29%。
以药品类型统计,创新中药36件(34个品种),同比减少7.69%;创新化学药品1031件(481个品种),同比增长0.19%;创新生物制品582件(432个品种),同比增长3.93%。
以注册申请类别统计,创新药IND 1615件(924个品种),同比增长3.59%;创新药NDA 34件(23个品种),同比减少50.72%。
以生产场地类别统计,境内生产创新药1298件(759个品种),同比增长2.93%;境外生产创新药351件(188个品种),同比减少4.36%。
2022年建议批准创新药21个品种,此前已获批的创新药现新增适应证品种2个。
2.改良型新药注册申请审结情况
(1)总体情况
2022年审结改良型新药注册申请507件(299个品种),同比减少8.32%。
以药品类型统计,改良型中药14件(14个品种),同比增加55.56%;改良型化学药品338件(202个品种),同比减少10.11%;改良型生物制品155件(83个品种),同比减少7.74%。
以注册申请类别统计,改良型新药IND 420件(247个品种),同比减少12.13%;改良型新药NDA 87件(52个品种),同比增加16.00%。 (下转3版)