3月22日至3月28日,医药领域的这些动态值得关注。
行业政策动态
1 国家药监局发布《化学仿制药参比制剂调整程序(试行)》(以下简称《调整程序》)。根据《调整程序》,《仿制药参比制剂目录》收载的参比制剂经评估已不再符合参比制剂遴选原则的,属于程序调整范围。品种的具体情形包括:因安全或有效性原因撤市;经技术改进,仍无法符合现行《中华人民共和国药典》或审评技术要求,不鼓励仿制;其他经评估不再符合参比制剂遴选原则的情形。
2 国家药监局发布公告,决定适用《S1B(R1):药物致癌性试验》《E14-S7B问答:致QT/QTc间期延长及潜在致心律失常作用的临床与非临床评价问答》国际人用药品注册技术协调会指导原则。
3 国家药品不良反应监测中心发布《国家药品不良反应监测年度报告(2022年)》(以下简称《报告》)。《报告》显示,2022年国家药品不良反应监测报告数量和质量稳步提升,全国药品不良反应监测网络收到《药品不良反应/事件报告表》202.3万份,每百万人口平均报告数增至1435份,全国97.8%的县级地区报告了药品不良反应/事件,国家基本药物监测总体情况基本保持平稳。
4 国家药监局药品审评中心(CDE)发布《儿童抗肿瘤药物临床研发技术指导原则》,明确儿童抗肿瘤药物在制定临床研发计划时总体有以下考虑:将儿童适应症开发纳入药物整体临床开发计划;保护患儿权益,避免在儿童受试者中开展不必要的研究;一般情况下,遵循儿童药物研发的普遍规律,按成人-青少年-小年龄段儿童的年龄顺序,逐步推进研发;遵循抗肿瘤药物研发的普遍规律,按末线/难治复发-前线/初治的疾病阶段,逐步推进研发等。
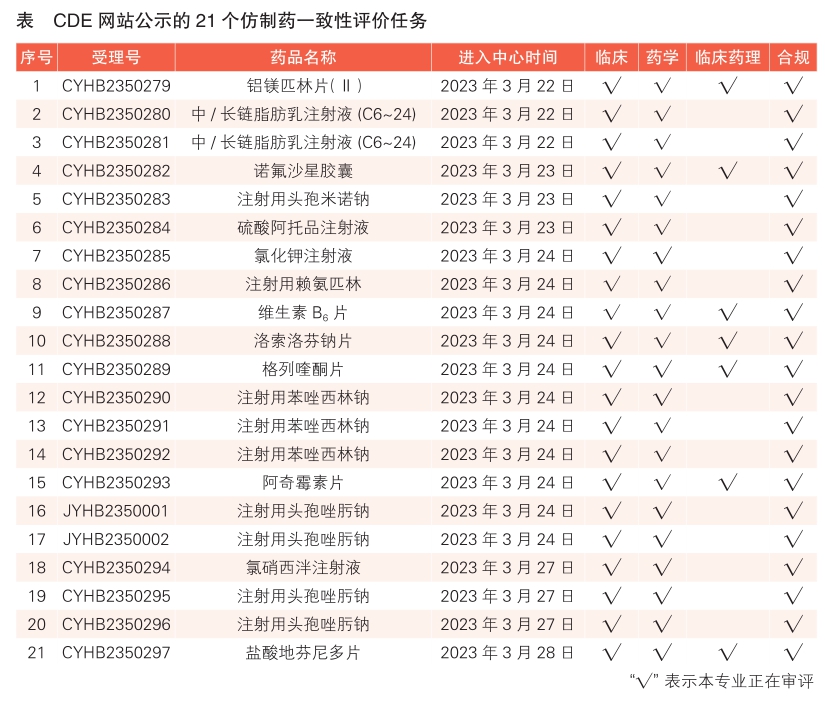
5 CDE网站公示21个仿制药一致性评价任务,涉及铝镁匹林片(Ⅱ)等药品(详见表)。
产品研发上市信息
1 国家药监局附条件批准广东众生睿创生物科技有限公司申报的1类创新药来瑞特韦片上市。该药为口服小分子新冠病毒感染治疗药物,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。
2 国家药监局发布5期药品批准证明文件送达信息,共包括398个受理号,涉及四川科伦药业股份有限公司等企业。
3 CDE承办受理38个新药上市申请,包括人脐带间充质干细胞注射液等药品。
4 艾美斐宣布,公司自主研发的用于治疗炎症性肠病(IBD)的创新药IPG11406获美国食品药品管理局(FDA)的新药临床试验许可,并将在美国开展Ⅰ期临床试验。
5 华海药业发布公告称,公司向美国FDA申报的左旋米那普仑缓释胶囊的新药简略申请(ANDA)已获得正式批准;向美国FDA申报的布瑞哌唑片的ANDA已获得暂时批准。
医药企业观察
1 康方生物宣布,公司将与礼新医药共同推进PD-1/VEGF双抗新药依沃西(AK112)联合靶向Claudin 18.2抗体偶联药物(ADC)LM-302针对相关实体肿瘤的一系列临床研究。此项合作包括治疗晚期消化道肿瘤的Ⅱ期临床试验,以及相关研究者发起的临床研究,用于确认联合治疗的剂量和给药频次、安全性及有效性。
2 海普瑞药业控股子公司昂瑞生物与友华生技签订许可协议,昂瑞生物同意授予友华生技独家权利,负责免疫疗法候选药物Oregovomab在中国台湾地区的商业化;同时,授予友华生技在中国香港和澳门地区的独家销售、营销和分销权的优先购买权。
3 美国Biohaven公司宣布与高光制药达成在大中华区域以外的独家开发与许可协议,引进后者研发的TYK2/JAK1抑制剂TLL-041。根据协议,Biohaven公司将支付2000万美元首付款(现金+股票)、9.5亿美元里程碑款及多层次、比例不等的销售分成。Biohaven公司将在2023年启动Ⅰ期临床试验,双方在全球协作进行临床开发。
药品集中采购
1 全国中成药联合采购办公室就《全国中成药采购联盟集中采购文件(征求意见稿)》(以下简称《征求意见稿》)公开征求意见。《征求意见稿》显示,此次全国中成药集采由湖北省医疗保障局牵头负责具体实施,覆盖全国30个省级行政单位。采购品种包括16个采购组的42个药品,采购周期为2年,视情况可延长1年;采购周期内采购协议每年一签。
2 山东省医疗保障局印发《关于加强药品和医用耗材集中带量采购全流程管理的通知》,针对报量、协议签订、供应保障、采购执行等集采全流程各环节明确了监测监管指标和惩戒约束措施,提出通过信息化支撑强化两个维度监测:一是供应监测;二是采购监测。
(刘思慧整理)