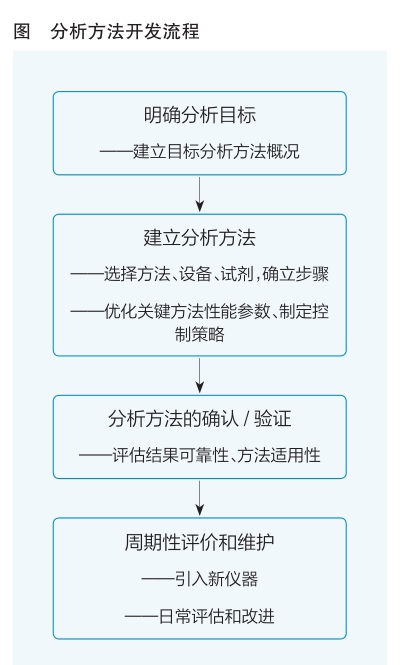
分析方法开发
生物类似药的药学研究中需要开发先进、灵敏的分析方法,以可靠地检测生物类似药和参照药之间的细微差异,确认生物类似药和参照药之间的药学相似性。在分析方法开发中,依据药学研究中各个检测项目所需分析方法具备的检测能力,选择检测仪器和检测方法,调试关键的方法学参数,对分析方法进行专属性、重复性和准确度等方法学特征评估,建立灵敏、科学、可靠、适用的分析方法,并在药物的生命周期中根据使用反馈,持续地进行方法优化、更新和验证(详见图)。
分析方法的建立
在分析方法开发早期,首先,要明确分析目标,并根据分析目标定义分析方法特性,比如分析对象、分析参数要求以及开发成功的标准。以基于反相色谱的氧化分析为例,分析目标的实现需要方法能分辨主峰和包含氧化成分的杂质峰。其次,要充分了解分析技术的基本原理以及适用的目标分析物范围,从而选择合适的分析方法。如分子排阻色谱(size exclusion chromatography,SEC)和十二烷基磺酸钠毛细管凝胶电泳(capillary electrophoresis sodium dodecyl sulfate,CE-SDS),都是生物药分子大小异质体鉴定的常用方法。SEC是根据待测物质的水合粒径大小进行分离的一种液相色谱技术,可以在蛋白非变性的状态下快速地获得单抗药物的单体含量,该方法对聚体和单体具有较好的分辨率,对单体和部分碎片的分离度欠佳。CE-SDS将蛋白变性处理后,依据不同分子量的蛋白质在电场中的迁移速率不同而分离,对单体和碎片具有更好的分离效果。因此,在分子大小异质体的纯度分析中,这两类纯度分析方法可以互为补充。确认分析方法之后,在方法适用的范围内选择检测设备和部件、试剂及其标准,并制定相应的样品制备过程、方法的操作步骤、数据分析方法和报告标准,初步建立分析方案。同时,建立方法的系统适应性标准,以确保系统在样品分析时能有效运行。最后,要全面认识和掌握各项分析参数的科学合理性,以支持方法稳定性。
分析方法的确认/验证
分析方法确认和验证的目的是,评估由该方法所产生结果的可靠性以及关键参数是否适用于其实际使用目的。药学研究的方法应用于特定质量属性的分析能力需要被详细确认,拟用于放行检测的方法需全面验证。在分析方法验证中,需采用标准物质进行试验。由于各分析方法具有各自的特点,并随分析对象而变化,因此需要视具体方法拟订验证的指标。验证指标包括:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。针对不同类型的分析方法,验证指标的侧重点有所不同。
分析方法在产品生命周期中的评价和维护
在产品的生命周期中,分析方法的应用可能因为一系列的原因失效,比如色谱柱的效期、试剂质量的不稳定性以及人为因素可能导致的偏差。分析方法的性能在日常放行检测、新人培训以及方法转移的过程中不断地受到检验。积累了充足的数据后,可以容易地评估一个给定方法成功运行的概率和需要进行异常调查的概率,并针对出现的问题对分析方法进行持续改进。改进之后的方法通常需要重新进行方法验证。在方法开发的早期阶段使用QbD原则,并将足够的资源投入分析方法开发和评价,可以减少后续分析方法的变更,在某些情况下避免重新验证的需要。
质量控制
生物类似药的质量控制可参考参照药的质量标准,并结合关键质量属性评估结果,对风险指数越高的质量属性制定更为严格的质量标准。同时,依据前期开发中积累的经验,将生产过程中涉及的系列关键参数控制在设计空间内,并建立反馈机制,根据开发过程中获取的新知识不断完善设计空间和质量标准。积累的知识和经验可在开发过程中支持产品质量检验和控制,并最终支持产品的批准上市。
根据法规ICH Q6B《质量标准:生物技术产品及生物制品的检测方法和验收标准》以及《生物制品质量控制分析方法验证技术审评一般原则》,控制策略包括但不限于原材料规范、工艺控制、中间产品测试和成品测试。I CH将控制策略定义为一组基于对当前产品和工艺的理解建立的控制计划,用以确保工艺性能和产品质量。控制策略与风险评估紧密相关,对临床疗效和安全性的影响越大,应实施更为严格的工艺控制策略。可通过实施过程分析技术(process analysis technology,PAT)对CQA进行实时监控,工艺参数可根据实时测试结果进行调整,具有相当的灵活性。控制策略也应该考虑到原材料的质量,早期工艺阶段使用的原材料可在后期纯化工艺中去除,通常对最终产品质量的风险程度较低,控制策略相对宽松。
一旦生产工艺被充分设计和定义,CQA被确定,设计空间被建立,就有必要实施控制系统来维护设计空间,从而保障产品质量的一致性。设计空间允许生产工艺步骤包含一定程度的可变性,这些可变性不影响最终产品质量。所以,工艺步骤中的可变性与产品质量标准密切相关。QbD策略利用在工艺开发过程中获得的经验来识别引起变化的潜在原因,随后使用相应的控制策略来减少特定工艺步骤和最终产品质量的总体变异性。
(摘编自《生物类似药从研发到使用》,中国医药科技出版社出版)