8月17日至8月23日,医药领域的这些动态值得关注。
行业政策动态
1 8月23日,世界卫生组织宣布中国通过疫苗国家监管体系评估。这不仅意味着我国拥有稳定、运行良好且完整统一的监管体系,能确保在我国生产、进口或流通的疫苗质量可控、安全、有效,也是我国疫苗出口全球的重要基础。
2 国家药监局药品审评中心(CDE)就《呼吸道合胞病毒感染药物临床试验技术指导原则(征求意见稿)》公开征求意见。征求意见稿主要内容包括临床试验的整体研发策略、临床药理学研究、探索性研究、确证性临床研究、其他特殊考虑等。征求意见稿提出,临床开发计划应首先关注有严重疾病风险的患者群体,不同的适应症、不同的人群应分别进行充分且对照良好的试验以支持其疗效。征求意见截止日期为2022年9月17日。
3 CDE就《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》公开征求意见。征求意见稿适用于将真实世界证据作为支持有效性和/或安全性评价的关键证据支持注册申请时的沟通交流,提出使用真实世界证据支持注册申请时,沟通交流会议讨论的核心问题、资料要求、会后要求等,为申请人在关键时间节点开展沟通交流提供建议,以提升药物研发效率。征求意见截止日期为2022年9月16日。
4 CDE就《生理药代动力学模型在儿科人群药物研发中应用的技术指导原则(征求意见稿)》公开征求意见。征求意见稿旨在对儿科人群药物研发过程中生理药代动力学模型的构建、评价和应用给出一般性建议,其适用范围为化学药品、生物药物的研发。征求意见截止日期为2022年9月16日。
产品研发上市信息
1 国家药监局发布3期药品批准证明文件待领信息,共包括213个受理号,涉及再鼎医药(苏州)有限公司等企业。
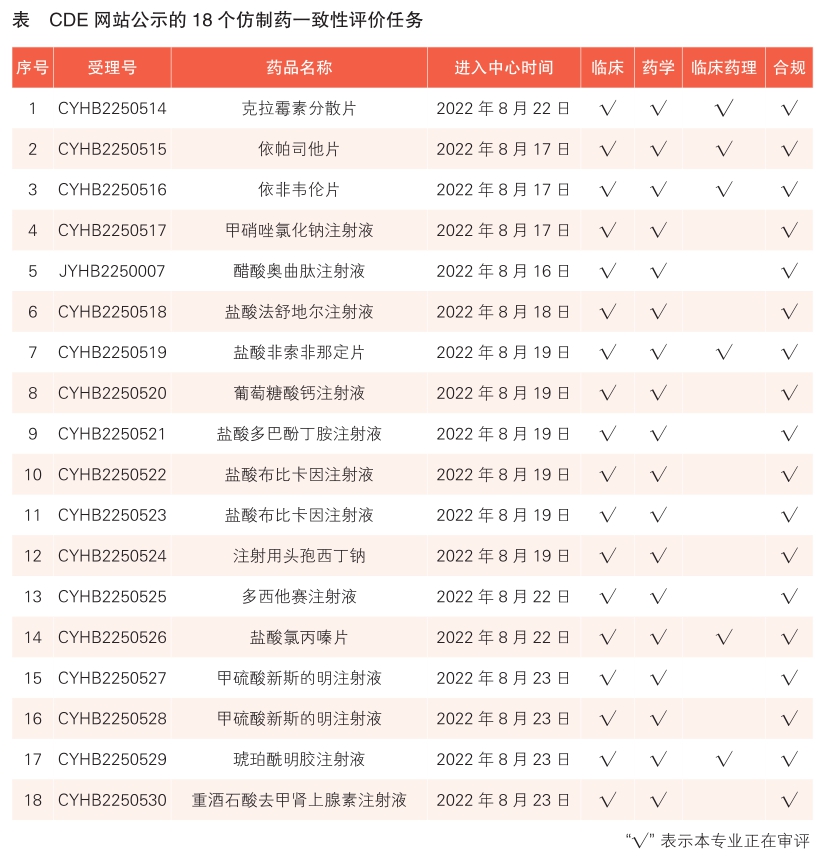
2 CDE网站公示18个仿制药一致性评价任务,涉及克拉霉素分散片等药品(详见表)。
3 CDE承办受理46个新药上市申请,包括HK010注射液等药品。
医药企业观察
1 汇宇制药发布公告称,其全资子公司Seacross Pharma(Europe) Limited已收到德国联邦药品和医疗器械机构核准签发的关于汇宇制药产品多西他赛注射液的上市许可。
2 华海药业发布公告称,其向美国食品药品管理局(FDA)申报的左旋米那普仑缓释胶囊的新药简略申请已获得暂时批准。
3 健康元发布公告称,已于近日获得瑞士证券交易所监管局关于其发行全球存托凭证(GDR)并在瑞士证券交易所上市的附条件批准。瑞士证券交易所监管局同意健康元发行的GDR在满足惯例性条件后在瑞士证券交易所上市。
4 盘龙药业宣布与陕西省中医药研究院签订技术开发(合作)合同。按照合同约定,双方拟共同参与研究开发治疗气虚肺热型感冒(或流感)中药新药清瘟护肺颗粒项目事项。
5 济民可信宣布,其联合旗下子公司上海济煜与罗氏及罗氏旗下基因泰克达成一项独家许可协议。根据协议,上海济煜将口服雄激素受体(AR)降解剂JMKX002992在全球的开发及商业化权利独家许可给基因泰克。基因泰克承担全部的开发及商业化费用,并将向上海济煜支付6000万美元首付款,在达到协议约定的里程碑时还需支付相应的开发和商业化里程碑款项,里程碑款项最高可达5.9亿美元。此外,上海济煜还将获得合作产品基于净销售额的梯度提成。
6 瑞顺生物宣布完成5900万元A+轮融资。本轮融资由粤财医药基金、百度风投等投资人参与,所融资金将用于瑞顺生物现货通用型DNT细胞系列药物研发,加速推进RC1012注射液治疗复发难治急性髓系白血病的验证性Ⅱ期临床试验及其临床新适应症研究,CD19-CAR-DNT细胞产品新药临床试验申报,以及新产品管线的临床前研究等。
药品集中采购
1 湖南省医保局发布《关于2022年省际药品价格联动结果执行后有关问题的补充通知》。通知显示,因2022年省际药品价格联动品规数量多,数据量大,且涉及备案采购流程调整优化,第三季度备案药品(含已暂停药品)常态化联动待已挂网药品数据梳理后开展,医疗机构备案申报待流程优化完善后启动。从本次价格联动申报数据分析,部分药品特别是急抢救药品价格差异较大,明显质价不符,后续将会进行专项治理,各医疗机构应合理选择采购价格适宜的药品。
2 江西省药品医用耗材集中采购联席会议办公室发布《关于执行首批中成药省际联盟带量采购中选结果的通知》,明确自2022年9月21日零时起,医疗机构开始执行中选结果。本次中成药带量采购周期为两年,首个采购周期为2022年9月21日至2023年9月20日。
(刘思慧整理)