开栏的话
将药品按处方药(Prescription Drug)和非处方药(Over the Counter, OTC)实行分类管理是国际通行的药品管理模式。即日起,本版开设“OTC药品管理”栏目,系统梳理各个国家和地区与OTC管理相关的内容,包括管理机构及其职能、法规制度等,敬请关注。
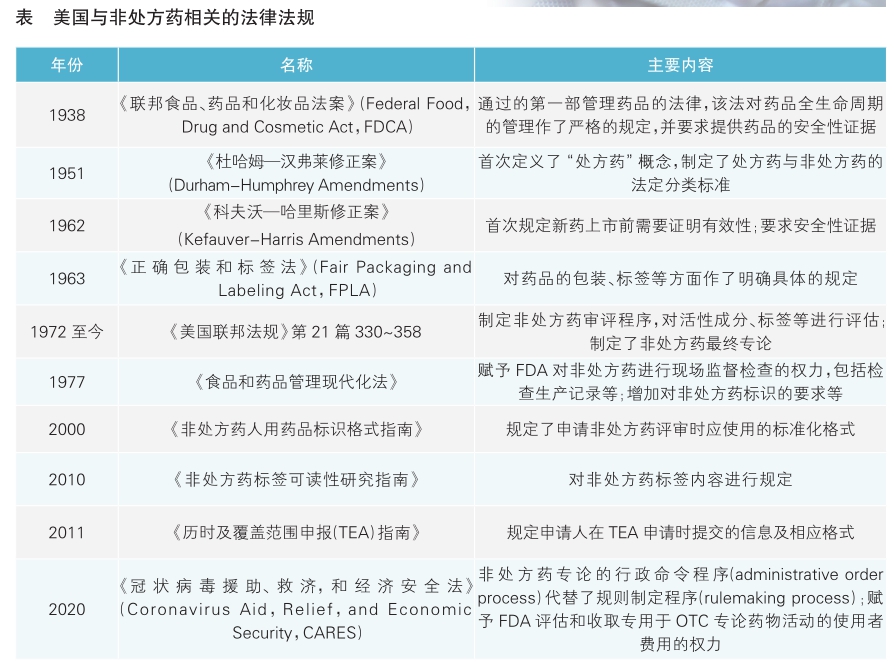
美国是最早建立药品分类管理制度的国家,其药品监管法律体系较为完善,涵盖法案、法规、指导文件及指南。
1906年,美国通过了《纯净食品和药品法》(Pure Food and Drugs Act),该法禁止假冒伪劣产品的流通,并要求产品标签必须提供准确的产品信息。该法的目的仅在于为消费者提供准确的产品信息,对于药品的销售无明确规定,药品即使未凭处方也可以销售。
1937年的磺酰胺事件促使《纯净食品和药品法》的修订,该法于1938年改名为《联邦食品、药品和化妆品法案》(Federal Food,Drug and Cosmetic Act, FDCA),该法赋予美国食品药品管理局(FDA)监督企业的权力,要求新药上市前需提交新药申请,并需要提供安全性证据证明其安全性,须有指导用药的标签。该法并未对药品实行严格的分类管理,只概括要求所有药品须有标签以说明如何安全用药。
随着技术进步,1951年通过的《杜哈姆—汉弗莱修正案》(Durham-Humphrey Amendments),即《处方药修正案》,在法律层面上定义了处方药的概念,该法确立了法定分类标准,规定了处方药的药品种类,包括:属于FDCA法规502(d)定义的易成瘾类药品;因药物毒性或其他潜在的有害后果,或使用方法使其成为不够安全的、需要在专业人员指导下使用的药品;在新药申请时仅限于非处方药类的药品。任何药品在没有指定为处方药之前,一般按照非处方药对待。该修正案还规定了处方药购买必须经过医师同意,而非处方药可供自选用药的消费者任意选购。
随后,1961年的“反应停”事件虽然未波及美国,但促进了《科夫沃—哈里斯修正案》(Kefauver-Harris Amendments)的通过,该法案新增条款以确保药品的有效性,要求制造商在药品上市前证明其药品是有效的,同时也进一步强化安全性审查。1972年,美国联邦法规制定了OTC药物审评程序,FDA药品审评与研究中心(CDER)便开展了大规模、长时间的OTC药物审评工程。在该OTC药物审评工程的基础上,FDA将审评结果按照一定标准分类,最终形成了OTC药物专论的雏形。目前,OTC药物专论仍在不断更新。
(摘编自《国外非处方药专论制度研究》,中国医药科技出版社出版)