□ 杨婉娟 母瑞红 余新华
医疗器械命名是监管的重要技术支撑手段之一。规范的医疗器械产品名称有助于对产品进行准确有效识别,为医疗器械科学分类管理奠定基础。由于医疗器械产品所涉领域广、专业跨度大、技术发展快、组成结构复杂,其规范命名难度较大。
为规范医疗器械产品命名,国家药品监督管理局组织医疗器械标准管理中心开展技术研究,统一医疗器械命名标尺,提出技术指导,已初步建立起命名体系,有效提升监管科学性和规范性。
医疗器械命名工作稳步推进
规范命名是各个国家和地区医疗器械监管的基本手段,也是国际协调的热点和难点。美国FDA在医疗器械分类数据库中明确了产品代码及通用名称,并建立了医疗设备通用术语系统(UMDNS)。欧盟基于UMDNS开发了全球医疗器械术语系统(GMDN),并通过亚洲医疗器械法规协调组织(AHWP)及全球协调工作组(GHTF)向各个国家和地区推广GMDN。日本借鉴GMDN和GHTF分类规则创建了本国医疗器械术语系统(JMDN)。国际医疗器械监管机构论坛(IMDRF)在《医疗器械唯一标识系统指南》中建议采用国际公认术语系统对医疗器械产品进行全球识别。
我国有关医疗器械命名的研究起步相对较晚,2000年发布的《医疗器械监督管理条例》未涉及医疗器械的命名,2004年版《医疗器械注册管理办法》发布实施后,产品名称成为注册证核准内容之一,但名称是否科学、合理、规范,缺乏统一的判断依据,基本上是参照分类目录或者沿用行业习惯进行核准,加之各地技术审评审批水平不均衡等,产品名称不规范、同物异名或者同名异物等问题日趋显现。
近年来,为探寻科学、适宜的命名方法,国家药监部门积极参与国际命名协调工作,委托省级药监部门开展分类命名政策研究及编码试点工作,并于2009年底成立医疗器械标准管理中心,负责医疗器械标准管理及分类、命名和编码技术研究,为系统开展医疗器械命名研究提供组织保障。
多维研究提供技术保障
对医疗器械命名的研究,主要包括对命名体系构建、通用名称命名规则制定及命名术语指南编制等方面的研究。
命名体系研究
医疗器械标准管理中心成立后,深入研究GMDN数据及相关标准,积极参与国际医疗器械命名协调工作,持续关注和推动建立医疗器械国际公认术语系统。分析比较欧盟、美国、日本等国家和地区医疗器械命名工作情况,深入开展各国应用GMDN情况调研和我国转化可行性研究,提出借鉴GMDN经验建立我国命名体系的技术建议。
2014年修订版《医疗器械监督管理条例》首次提出“医疗器械应当使用通用名称。通用名称应当符合国务院食品药品监督管理部门制定的医疗器械命名规则”。医疗器械规范命名有了法规依据和明确目标。
基于相关要求,医疗器械命名工作应遵循以下思路:制定规则解决命名中的原则性和基本性问题,采用“活字印刷式”的命名技术方案,利用核心词和特征词组成通用名称,分步骤、分领域制定命名术语指南,形成命名数据库,利用标准化和信息化等手段,分阶段解决医疗器械命名不科学、不规范、不系统等问题。
医疗器械命名体系由通用名称命名规则、命名术语指南通则及各领域命名术语指南、命名数据库组成,体系的建立有助于从源头准确区分和定位监管对象。根据不同需求,可利用通用名称、核心词和特征词对产品进行识别,从不同层次和角度实现医疗器械精细化管理,对提升监管效能和鼓励产业创新发展有重要意义。
通用名称命名规则制定
按照命名工作整体思路,参照药品、化妆品、保健食品命名规则的格式及内容,借鉴GMDN研究成果,2015年,国家药监部门制定了《医疗器械通用名称命名规则》(以下简称《规则》)。《规则》于2016年4月1日开始实施,并在《医疗器械分类目录》修订工作中,为品名举例的规范提供依据。
《规则》及其说明解读文件重点明确了以下内容:规范命名的目标和对象为通用名称;提出文种、禁用语等要求,对命名进行初步规范;明确通用名称的结构组成为一个核心词和一般不超过三个特征词;提出命名的途径和方法,特征词和核心词根据医疗器械命名术语指南制定。
《规则》是首部针对医疗器械命名的法规文件,是规范指导通用名称的纲领和基本原则。《规则》实施以来,原有产品名称中不符合“通用”定义、不符合基本原则、夸张绝对等内容得到有效规范,大部分名称相对混乱、误导识别等问题得到解决,对规范命名达成共识起到了统领的作用,对于完善我国医疗器械监管法规体系、强化科学规范的管理原则、夯实监管基础意义重大。
命名术语指南编制
《规则》提出了命名的整体要求,但不能解决各领域产品命名的具体问题,需研究制定命名术语指南对不同专业领域的核心词和特征词的选取原则、通用名称命名结构形式、遣词用字等进行规范。
2017年,《“十三五”国家药品安全规划》和《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》相继发布。其中,《“十三五”国家药品安全规划》要求加快推进医疗器械分类管理改革,“发布新版《医疗器械分类目录》,按专业领域设置研究制定22个命名术语指南,建立医疗器械分类、命名及编码数据库。”国家药监部门将在前期研究的基础上,按照2017年发布的《医疗器械分类目录》(以下简称《分类目录》)子目录领域设置,组织技术单位分三批研究制定22个命名术语指南。第一批涉及3个领域:医用成像器械,有源植入器械和口腔科器械。第二批涉及11个领域:无源手术器械,无源植入器械,妇产科、生殖和避孕器械,骨科手术器械,放射治疗器械,呼吸、麻醉和急救器械,透析、体外循环器械,医疗器械消毒灭菌器械,医用康复器械,中医器械,医用软件。第三批涉及8个领域:有源手术器械,神经和心血管手术器械,医用诊察和监护器械,物理治疗器械,注输、护理和防护器械,患者承载器械,眼科器械,临床检验器械。
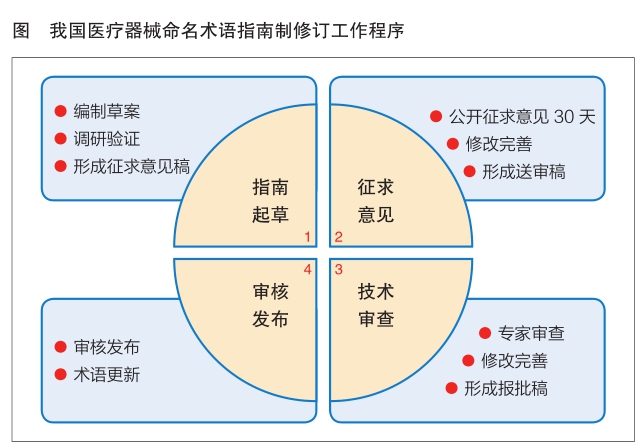
术语指南是命名规则在不同专业领域的具体指导性文件,指南明确了相应领域产品核心词和特征词的选取原则,以术语表的形式详列了可选命名术语及描述,并通过典型示例指导通用名称的制定,为应用方提供了直接可查找的命名术语词典。作为技术性指导文件,术语指南的内容将依据法规要求和技术的不断发展,及时更新调整。命名术语不仅可指导、协调各方形成统一、规范的通用名称,也是医疗器械研发、生产、监管、应用方识别产品主要特征的数据源,对提高审评审批效率、强化科学监管和提升医疗保障水平具有重要意义。我国医疗器械命名术语指南制修订工作程序依次为指南起草、征求意见、技术审查、审核发布(见图)。
目前,按照国家药监局相关实施意见,“命名术语指南”定名为“命名指导原则”。《医疗器械通用名称命名指导原则》已于2019年12月发布,各个领域命名指导原则制修订工作也正在有序推进中。
命名体系建设是长期过程
医疗器械命名是科学监管的重要基础,我国医疗器械命名工作是新的尝试,更是循序渐进的长期过程。下一步,药监部门将继续按照“四个最严”要求,以满足新时代公众用械需求为宗旨,以创新监管方式为目标,进一步加强命名体系建设研究,分步规范医疗器械产品通用名称,为引领产业健康发展、提高监管效能、优化技术服务夯实基础,为实现科学监管和智慧监管提供坚实的技术支撑。
【摘编自:杨婉娟,母瑞红,余新华.医疗器械命名研究与思考[J].中国食品药品监管.2020.03(194):22-25.】