□ 丁恩峰
目前,我国绿叶制药等一些企业正在尝试通过505(b)(2)路径向美国FDA提交新药申请。那么,什么是505(b)(2)?通过该路径申请有哪些优势?
3条新药申请路径
美国FDA历来以高标准、严要求著称,其新药审评审批尺度和技术标准,一直引领着全球药品研发的潮流与方向。对于新药审批,FDA有着严格的法规制度和管控体系:1938年颁布的《联邦食品药品化妆品法》规定,所有新药在美国上市之前都必须向FDA提出正式的新药申请。1984年美国国会通过了《药品价格竞争和专利期修正案》(Hat ch-Waxman Amendment),修订后的《联邦食品药品化妆品法》505部分为新药申请提供了3条路径:
505(b)(1)申请包含完整的安全性和有效性研究报告。
505(b)(2)申请包含完整的安全性和有效性研究报告,但至少有部分信息来源于非申请者开展或申请者无权引用的研究。
505(j)申请包含证明拟申报药物与参比制剂有着完全相同的活性成分、剂型、规格、给药途径、标签信息、质量、特性和适应证等信息。
505(b)(1) 和505(b)(2)都属于新药申请(NDA),而505(j)则属于简略新药申请(ANDA),即仿制药申请。
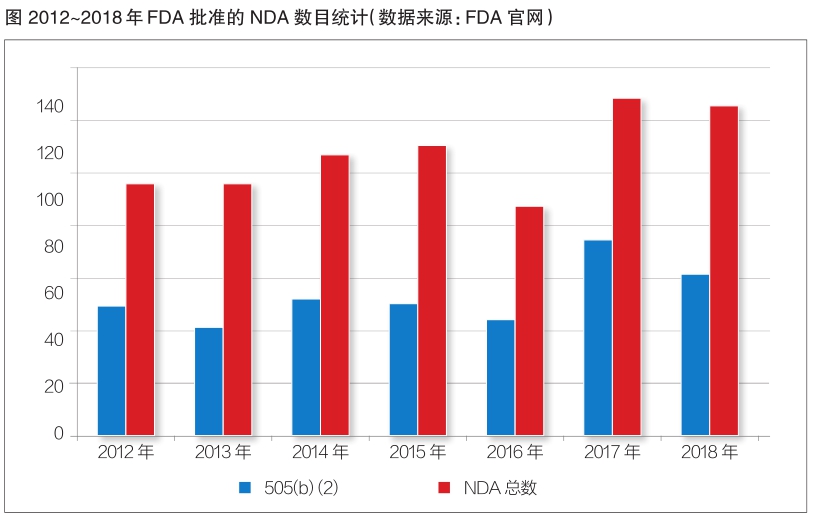
近年来,申报FDA505(b)(2)越来越受到业界的关注和青睐。从FDA发布的数据我们可以看到:近几年505(b)(2)的申报数量明显增多,其中2012年和2017年,以505(b)(2)方式获批的新药数量超过了获批NDA总数的一半(见图)。下面我们主要从505(b)(1) 和505(b)(2)的区别、国内外505(b)(2)申报的典型事例来具体介绍一下505(b)(2)申报的相关情况。
505(b)(1) 和505(b)(2)的区别
505(b)(1) 和505(b)(2)虽然都属于新药申请(NDA),但二者有诸多不同之处:
适应的类型
505(b)(1) 适用于新分子实体(NCE)。
505(b)(2) 适用于新分子实体(NCE)以及已批准药物的改变。也就是说,505(b)(2)适用于改良型新药,因此采用505(b)(2)路径申请最多的是已批准药物的改变,包括适应证、配方、剂型、给药途径、用药方案等的改变。
数据资料的提交
505(b)(1) 需要提供完整的临床前数据和临床安全性和有效性数据报告。
505(b)(2)可部分依赖和引用已发表的文献以及并非由申请者开展的研究,用于支持申请所需要的安全性和有效性证明。可能包括临床数据,但有时可能只是基于生物利用度的数据。
研发时限及其它
从大量的临床前研究及临床研究的时间来看,505(b)(2)可以通过参考已发表的文献以及并非由申请者开展的研究,用于支持药物申报所需要证明的安全性和有效性。这样可以省去一些重复的试验,节约大量时间和金钱,投入回报率较高。正因为如此,505(b)(2)已成为诸多医药企业的新药开发策略之一。
FDA共有4种新药加快审评方式:快速通道(Fast Tr ack)、突破性疗法通道(Br eak Through)、优先审评(Pr iority Review)以及加速审批(Accel erated Approval)。对于一个新分子实体,通过505 (b)(1)途径可以获得FDA4种加快审批的机会更多,这样在审批时间上也可能与505(b)(2)相差不多甚至更快,这是505(b)(2)的局限性之一。另外,采用505(b)(2)途径申报新药还可能存在因专利问题被耽误等局限性:505(b)(2)申请必须包含《美国联邦法律》第21条中所要求的专利证明(Patient Cert if ication),并提前告知专利持有方;采用505(b)(2)途径申报的药品很多时候还需要额外的试验和数据来支持对已批准药物的改变。
选择505(b)(2)路径典型案例
改变剂型的案例
美国强生公司的利培酮属于采用505(b)(2)申报路径的典型案例。利培酮由美国强生公司研发,用于治疗急性和慢性精神分裂症。为拓展利培酮的生命周期,强生对其共进行了6步升级:利培酮常规制剂(片剂)、利培酮速释制剂(口崩片、口服液)、利培酮长效注射剂(Risper dal Consta)、代谢产物的缓释制剂(Invega)、代谢产物前药的长效注射剂(Invega Sust enna)、代谢产物前药的超长效制剂(Invega Tr inza),通过这种升级逐步延长了产品生命周期。在利培酮常规制剂面临专利悬崖时,美国强生通过努力,使得改良型利培酮产品带动利培酮系列产品市场销售持续增长。
改变适应证的案例
格隆溴铵由诺华公司开发,用于术前麻醉或插管过程中减少胃部和静脉分泌物。通过505(b)(2)申报途径,研究者在原先药物基础上开发出新的液体制剂,用于治疗罕见病脑性瘫痪。除此之外,该药物还被开发成多种剂型的长效毒蕈碱受体拮抗剂 (LAMA), 用于治疗慢性阻塞性肺病(COPD)。
改变给药途径的案例
Synera为美国ZARS公司开发的加热型局部贴片,在2005年由FDA批准上市,主要用于浅表静脉通路的镇痛、浅表皮肤切除术、电流干燥手术、皮肤刮除活检的麻醉等。Syner a的成分为利多卡因和地卡因,二者的剂量均为70mg,其中利多卡因是早已批准的局部麻醉经典用药;而地卡因是之前FDA未正式批准的外用局部麻醉剂。Syner a则是两种局部麻醉剂的组合,适用于完整皮肤。FDA在审评时依据的是已公开文献、临床安全性和有效性研究数据,并要求申报方提供了药物代谢动力学数据。
新配方案例
2015年,FDA批准Al l er gan公司的Avycaz上市。Avycaz是头孢他啶和新型β-内酰胺酶抑制剂阿维巴坦的复方制剂。阿维巴坦是新分子实体,针对丝氨酸为活性位点的β-内酰胺酶抑制剂;而头孢他啶则是第三代头孢类抗菌药。FDA同意该公司用头孢他啶之前的安全性和有效性数据申报,并要求递交非临床数据、I期和Ⅱ期临床数据。因阿维巴坦难以开展单方研究,故主要是提供受试者服用复方制剂后的数据,并通过开展体外和动物模型研究,确定添加阿维巴坦后头孢他啶对非敏感细菌的活性作用。
国内企业积极探索505(b)(2)申报
2019年第四季度,百济神州的泽布替尼和石药集团欧意药业的马来酸左旋氨氯地平获得FDA的新药上市批准,实现了国内企业对美国NDA申报的突破。
基于505(b)(2)途径的便利性,目前国内一些企业正在积极尝试505(b)(2)申报路径。
比如绿叶制药,其征战FDA新药注册的产品是注射用利培酮缓释微球(产品编号:LY03004),选择的是505(b)(2)路径申报。在完成I期临床试验后,绿叶制药与FDA进行多次沟通讨论。2015年9月,FDA正式确认利培酮缓释微球注射剂不需要再进行临床试验,可在美提交新药NDA申请。
据了解,绿叶制药通过505(b)(2)途径申请的药品还有:治疗帕金森病的注射用罗替戈汀缓释微球,用于治疗前列腺癌的注射用醋酸戈舍瑞林缓释微球,治疗精神分裂症和分裂情感性障碍的帕利哌酮缓释混悬肌肉注射剂等。
据媒体报道,厦门力品药业的创新制剂盐酸帕洛诺司琼口腔黏膜剂,目前也在通过505(b)(2)路径向FDA申报。这是我国首个在国际上获批临床的口腔黏膜剂型。
此外,浙江医药股份有限公司旗下全资子公司浙江创新生物有限公司,为其注射用盐酸万古霉素项目以505(b)(2)途径向FDA进行NDA申报,获得了FDA的同意。
通过数据汇总分析,我们可以看到,对于想积极拓展美国市场的中国企业来说,需要深入研究美国相关法规和指南,根据自己产品特点,选择合适的申报路径,以便更有效地利用已有资源,这样可以起到事半功倍的效果。同时,国内企业还需要持续加强质量体系建设,强化GMP管理,这样有助于产品在美国的注册。