今年1~6月,美国FDA共批准1022份ANDA(仿制药申请),与去年同期相比增长了60%,创下过去五年来同期批准量新高。
据科睿唯安Newp or t数据库,今年上半年,美国NCD(Nat i o nal Cov er age Det er mi n a t i on,国家医疗覆盖指标)日期到期的药物多达54个,化合物专利到期的药品数量达到60个,这或许是今年上半年ANDA获批数量大幅度增加的原因之一。
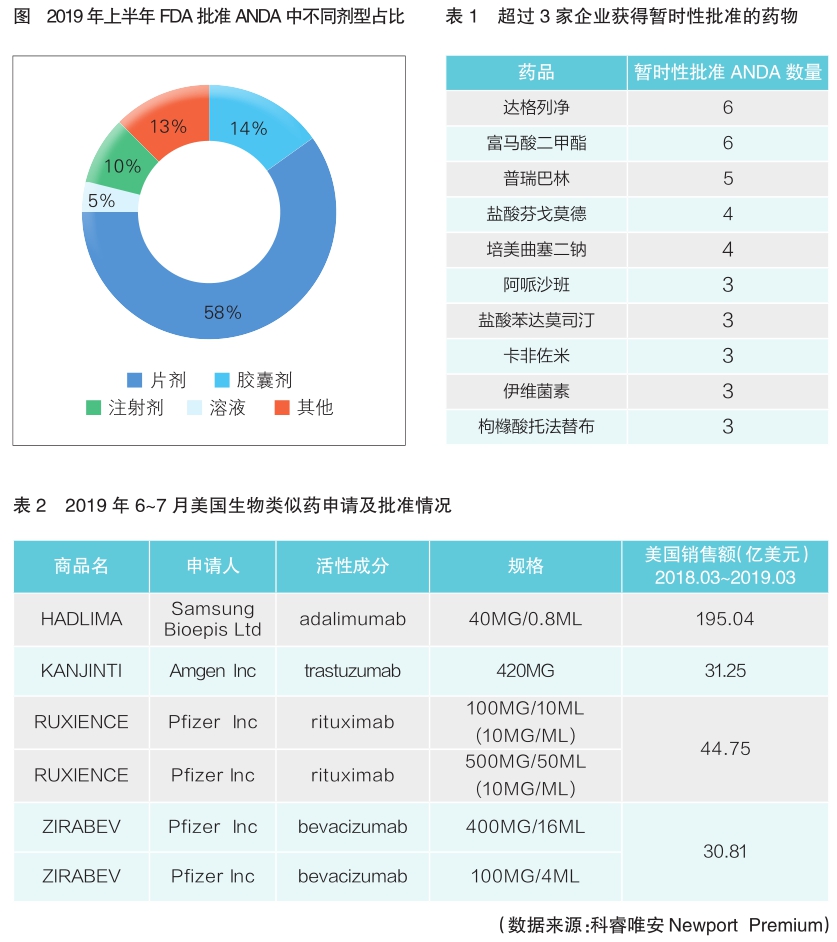
今年上半年获批的ANDA中,不同剂型所占比例为:片剂58%,胶囊剂14%,注射剂10%,溶液5%(见图)。由此可见,口服制剂仍是市场中的主流剂型。
此外,根据Newpor t数据库,今年下半年至2020年,美国化合物专利到期药品数量达到131个。今年上半年获得暂时性批准的ANDA数量为95个,涉及56个药物,其中的19个药物有至少2家仿制药企业获得暂时性批准,超过3家企业获得暂时性批准的药物见表1。
虽然美国给予首个PI V( Par agr aph I V)专利挑战成功的企业(FTF)180天的市场独占权,但近年来,随着更多的仿制药生产企业参与到专利挑战中,以及NCE-1(FDA法规规定,仿制药最早可在NCE-1日申报,即新药获批后第5年的第1天,也就是新药上市后满4年,该时间通常被认为是首仿日)所带来的效应,单个药品的市场独占权常被几家仿制药企业共享,FTF的市场独占获利优势正逐渐丧失。即便如此,仿制药企业通过PI V专利挑战而更早进入市场的策略和行动依然明显。
美国市场的生物药销售占全球市场近 50%的份额。随着FDA和AAM(普享药协会)大力推进生物类似药的批准和商业化,今年上半年,共有10款生物类似药获得批准。2019年6~7月美国生物类似药申请及批准情况见表2。至此,FDA共批准了9个生物药的38个aBLA(简略生物制品许可申请),另有6个药物的申请资料已递交。
在美国,围绕专利和价格的政治辩论可能决定其国内生物类似药市场的长期生存能力。2015年,Amgen公司Neupogen (非格司亭)的仿制药 Zar xi o获批,正式开启了美国生物类似物市场。Zar xi o很快占据了一定的市场份额。2018年,在美国使用的短效非格司亭中,Zar xi o所占比例达到45%。
不同于化学药,生物药通常会有更加广泛的专利保护策略,以阿达木单抗为例,艾伯维便持有130多项专利。
此外,政策、注册路径、定价、全民医保情况、医患接受程度、医保谈判、国际定价指数及国外进口药品等因素都会影响生物类似药市场,延缓或削弱生物类似药研发的商业积极性。不同于欧洲更加广泛的市场推广和接受程度,美国生物类似药上市面临的障碍更多。
今年上半年,美国新增324份DMF(Dr ug Mast er Fi l e,药物主文件),其中,我国获得54份;欧盟COS认证新增145份,我国获得31份。
上半年,印度获得的DMF和COS认证数量均远远高于居第二位的我国。在Newpor t 数据库中,原料药工厂总部在印度的企业共有637家,在我国的有1457家,从整体数量上看,我国企业数量是印度的2倍多。(科睿唯安供稿)