□ 徐超 傅继欢
包虫病又名棘球蚴病,是一种人畜共患寄生虫病,主要由人感染棘球绦虫的幼虫(棘球蚴)所致。我国有囊型包虫病和泡型包虫病两种,分别由细粒棘球绦虫的幼虫和多房棘球绦虫的幼虫寄生人体组织器官中导致。两种绦虫都必须在哺乳类动物体内寄生才能完成生活史。细粒棘球绦虫的终末宿主一般为犬和狼;多房棘球绦虫的终末宿主一般为狐狸、犬和狼。
包虫病呈全球性分布,在我国主要流行于牧区和半农半牧地区,其中以新疆、西藏、宁夏、甘肃、青海、内蒙古、四川7省区最为严重。据相关文献,我国西部地区人群包虫病感染率为3.1%~31.5%,患病率为0.5%~5.0%,其中,青藏高原部分地区人群患病率为5.0%~10.0%。我国西部地区包虫病平均患病率为1.08%,受威胁人口约6600万,每年造成直接经济损失30亿元。
包虫病诊断依据
根据现行诊断标准,包虫病的临床诊断需综合考虑流行病学史、临床表现、影像学检查、实验室检查及病原学检查几方面。
流行病学史
这部分主要考虑患者是否有在流行区居住、工作、旅游或狩猎史,或与犬、牛、羊等家养动物或狐、狼等野生动物及其皮毛的接触史;或在非流行区有从事来自流行区的家畜运输、宰杀、畜产品及皮毛加工等暴露史。
临床表现
包虫病患者的主要临床表现为棘球蚴的囊占位所致的压迫、刺激以及囊破裂引起的一系列症状。囊型包虫病可发病于全身多个器官,以肝、肺为常见;泡型包虫病原发病灶几乎都位于肝脏。
影像学检查
主要通过B超扫描、X线检查、计算机断层扫描或磁共振检查,发现占位性病变。
实验室检查
通过酶联免疫吸附试验、间接红细胞吸附试验、PVC膜快速ELISA(酶联免疫吸附剂测定)、免疫印迹技术等,对包虫病相关的特异性抗体、循环抗原、免疫复合物进行检测。
病原学检查
在手术活检材料、切除的病灶或患者排出物中发现棘球蚴的囊壁、子囊、原头节或头钩。此为包虫病的确诊方法。
相关检测产品
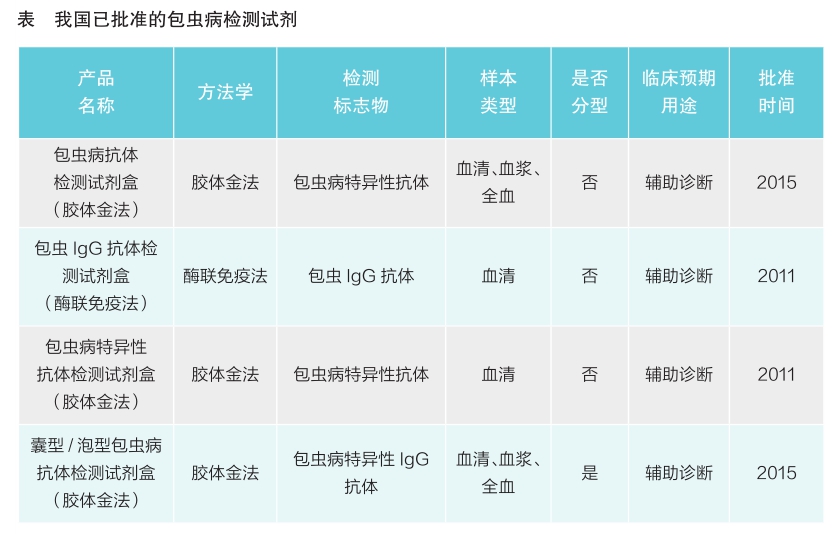
对来源于患者或疑似患者人体样本中的包虫病感染相关生物标志物进行检测是辅助诊断该病的重要手段。相关生物标志物包括特异性抗体、循环抗原、免疫复合物、病原体核酸等。我国已批准四个包虫病抗体检测试剂(见表)。已批准产品均采用免疫学方法对样本中的病原体抗体进行检测,但免疫学检测有其自身的局限性:一方面,由于细粒棘球蚴和多房棘球蚴两种病原体自身抗原存在交叉,导致应用抗体检测来区分囊型/泡型的效果欠佳;另一方面,抗体检测无法区分现症感染与既往感染。
随着检测技术的进步,病原体核酸及其游离DNA检测为包虫病感染的辅助诊断提供了新思路。目前,国际上尚无包虫病核酸检测的相关产品。我国已有细粒棘球蚴和多房棘球蚴核酸检测试剂盒(PCR-荧光探针法)获准进入国家药品监督管理局创新医疗器械特别审查程序,该产品临床应用的安全性和有效性仍在验证中。
病原体相关游离DNA简介
近年来,随着对寄生虫血浆游离DNA(cf DNA)的研究取得进展,cf DNA在寄生虫病检测中的运用得到快速发展,目前已有应用cf DNA检测对疟原虫、弓形虫、利士曼原虫、锥虫、血吸虫等寄生虫感染进行辅助诊断的报道。患者感染寄生虫后,体内出现虫源DNA,可能是由于虫体或虫卵的细胞或碎片在增生、成熟、脱落、腐烂、崩解等过程中主动分泌或被动释放出的内部DNA进入宿主体液循环系统所致;也有研究表明,绦虫主动分泌的外泌体是患者体内出现虫源DNA的重要原因。基于上述研究,检测样本中细粒棘球蚴和多房棘球蚴两种病原体cf DNA为该病的辅助诊断提供了理论基础。
寄生虫源cf DNA的检测在临床应用中具有一定优势。一方面,可根据特异性的基因序列对两种不同种类的病原体进行分型,从而达到对疾病分型的目的;另一方面,患者样本中存在寄生虫DNA,在一定程度上提示患者可能感染相关病原体。然而,cf DNA作为一种新的标志物,要达到能够应用于临床检测的要求,还需在现有理论的基础上进一步研究。
首先,应进一步明确患者在疾病不同进展阶段的血浆cf DNA浓度变化情况,并以此为基础,确定该标志物的临床预期用途(如疾病早筛、辅助诊断、鉴别诊断及治疗监测等)。
另外,还应依据所拟定的标志物预期用途,对该标志物进行临床验证,临床研究应考虑入组人群、对照方法等。若将该标志物用于对疾病的鉴别诊断,入组人群应为包虫病疑似感染人群,其中,不同大小占位性病变病例、不同病灶退变病例、不同基因型病例等均应入组,还应考虑非包虫病病例的干扰。对用于疾病鉴别诊断的临床研究,其对照方法应为疾病确诊的标准,即病原学检查。
我国包虫病防控形势严峻,且该病流行区多位于相对偏远、落后的地区。目前,对包虫病的诊断在很大程度上依赖于影像学和病原学,这种诊断方式对临床医生的专业技术水平有较高的要求,并存在一定程度的误诊、漏诊风险。cf DNA检测方法操作较简便,结果易于解读,若能将其应用于临床,对包虫病的诊断将起到积极作用。
(作者单位:国家药品监督管理局医疗器械技术审评中心)